- litiumkarbonat kemiska egenskaper, användningsområden, produktion
- beskrivning
- kemiska egenskaper
- använder
- toxicitet
- beredning
- reaktioner
- kemiska egenskaper
- fysikaliska egenskaper
- använder
- använder
- använder
- beredning
- Definition
- indikationer
- varumärke
- allmän beskrivning
- Reaktivitetsprofil
- säkerhetsprofil
- kemisk syntes
- potentiell exponering
- Frakt
- reningsmetoder
- inkompatibiliteter
litiumkarbonat kemiska egenskaper, användningsområden, produktion
beskrivning
litiumkarbonat (molekylstruktur är Li2CO3, engelska namnet är litiumkarbonat) som en färglös monoklinisk kristall eller vitt pulver. Densitet är 2,11. Smältpunkten är 618 kg. Utan deliquescence är den stabil i luften. Låg löslighet i vatten minskar lösligheten med ökande temperatur. Lösligheten i kallt vatten är större än varmt vatten. Det är lösligt i utspädd syra, olösligt i alkohol och aceton. Koldioxid införs i den vattenhaltiga suspensionen av litiumkarbonat, litiumkarbonat omvandlas till litiumsyrakarbonat och löses upp. Om lösningen av litiumsyrakarbonat upphettas och sedan släpper ut koldioxid och fälls ut litiumkarbonat. Litiumkarbonatets natur kan användas för att avlägsna föroreningar från litiumkarbonat. Eftersom litiumjon har en stark polariserbarhet är sålunda termisk stabilitet hos litiumkarbonat sämre än annat alkalimetallkarbonat, när det upphettas till över smältpunkten sönderdelas det för att producera koldioxid och litiumoxid.
kemiska egenskaper
litiumkarbonat är ett vitt monokliniskt kristallint fast ämne. Typiskt för karbonater reagerar litiumkarbonat med syror starkare än koldioxid eller kolsyra för att ge litiumsaltet av syran och koldioxiden. Reaktionerna kan utföras i en lösning, som en vattenhaltig uppslamning, eller, mindre effektivt, med fast litiumkarbonat.
litiumkarbonat uppvisar en låg vattenlöslighet för ett alkalimetallkarbonat. Lösligheten minskar med ökande temperatur. Det är inte hygroskopiskt och är generellt stabilt när det utsätts för atmosfären. Det är faktiskt den normala ändföreningen som uppstår när många basiska litiumföreningar utsätts för atmosfären. Litiumkarbonat kan lösas i vatten genom omvandling till vätekarbonatet. Utsläpp av koldioxid genom uppvärmning av lösningen av litiumvätekarbonat orsakar återutfällning av litiumkarbonatet.
använder
litiumkarbonatindustrin är en global högmonopolindustri, den nuvarande produktionskapaciteten är huvudsakligen koncentrerad till tre utländska tillverkare av KVM, FMC, Chemetall och så vidare.
industriellt litiumkarbonat används vid tillverkning av andra litiumsalter, såsom litiumklorid och litiumbromid och så vidare. Det fungerar också som litiumoxidmaterial i emalj, glas, keramik och porslin emalj, och det läggs också till den elektrolytiska cellen för elektrolys av aluminium för att öka den nuvarande effektiviteten och minska cellens inre motstånd och badtemperaturen. I medicin används den främst för behandling av mani, kan förbättra sina känslomässiga störningar för schizofreni. Det har effekten av att höja perifera leukocyter; kan användas för syntetiskt gummi, färgämnen, halvledare och militär försvarsindustri och så vidare; för produktion av litiumtantalat, litiumniobat och annan akustisk kvalitet enkelkristall, monokristallin optisk kvalitet etc; för beredning av akustisk kvalitet enkelkristall.
batterikvalitet litiumkarbonat används huvudsakligen för framställning av litiumkoboltoxid, litiummanganoxid, ternära material, litiumjärnfosfat och andra litiumjonbatterikatodmaterial; används i en matrismodifierare; som aneuroprotektiv effekt av litiumkarbonat vid amyotrofisk lateral skleros.
toxicitet
litiumkarbonat har en signifikant stimulerande effekt, för det första har skador på mag-tarmkanalen, njurarna och centrala nervsystemet. Toxicitetsordning för litiumföreningar är Li <LiCl < Li2CO3, högsta tillåtna koncentration: Litiumkondensation och fragmentering aerosol var 0,05 mg/m3 och 0,5 mg/m3.
använd gummihandskar och skyddsmaskar när du arbetar för att skydda andningsorganen mot damm.
beredning
litiumkarbonat erhålls som en mellanprodukt vid återvinning av litiummetall från dess malm, spodumen (se litium). Den framställs genom att blanda en varm och koncentrerad lösning av natriumkarbonat med litiumklorid eller sulfatlösning.
Li2SO4 + Na2CO3 Audric Li2CO3 + Na2SO4
reaktioner
litiumkarbonat reagerar med utspädda syror, befriande koldioxid:
Li2CO3 + HCl Audric LiCl + CO2 + H2O
termisk sönderdelning ger litiumoxid och koldioxid:
Li2CO3 Audric Li2O + CO2
reaktion med kalk producerar litiumhydroxid:
Li2CO3 + Ca (OH) 2 c 2lioh + CaCO3
karbonatet reagerar med smält aluminiumfluorid som omvandlas till litiumfluorid:
3Li2CO3+ 2alf3 C 6lif + 3co2+ Al2O3
Den kombinerar med koldioxid i vattenhaltig uppslamning som bildar lösligt bikarbonat, som sönderdelas till karbonat vid uppvärmning:
Li2CO3+ CO2+ H2O C 2lihco3
bikarbonatet kan inte separeras i fast form. Det finns endast i lösning när karbonat löses upp i vatten mättat med CO2under tryck.
kemiska egenskaper
litiumkarbonat är ett vitt hygroskopiskt pulver.
fysikaliska egenskaper
vita monokliniska kristaller; brytningsindex 1.428; densitet 2.11 g/cm3; smälter vid 723 CCC; sönderdelas vid 1,310 CCL; låg löslighet i vatten (1,54 g/100 g) vid 0 CCL; 1,32 g//100 g vid 20 CCL), löslighetsminskning med temperatur (0,72 g/100 g vid 100 CCL); olöslig i aceton och etanol.
använder
det vanligaste litiumläkemedlet är litiumkarbonat, som har antimaniverkan. Det antas att litium förändrar transporten av natriumjoner i neuroner, vilket påverkar det intercellulära innehållet i katekolaminer, normaliserar mentala tillstånd och inte orsakarallmän slöhet. Det används för maniaförhållanden av olika ursprung, förebyggande åtgärder och för behandling av affektiva psykoser.
använder
litiumkarbonat används som en förening för framställning av metalliklitium. Litiumkarbonat är resultatet av behandling av mineralspodumen med svavelsyrasyra och sedan tillsats av kalciumkarbonat. Det används som ett antidepressivt medel.
använder
vid framställning av glasyrer på keramiskt och elektriskt porslin.
beredning
litiumkarbonat framställs genom utfällning av lithiumion med karbonatjon från en vattenlösning. En annan process, som utförs på en mindreskala, är reaktionen av en lösning av litiumhydroxid med koldioxidgas. Lithiumcarbonate fälls ut och återvinns från supernatantlösningen.
Definition
litiumkarbonat: ett vitt fast ämne, Li2CO3; rd 2.11; MP 723 CCC; sönderfallovan 1310 Ccc. Den framställs kommersiellt genom att malmen behandlas med svavelsyra vid 250 c-c och genom att produkten läts ut för att ge en lösning av litiumsulfat. Karbonaten erhålles sedan genom utfällningmed natriumkarbonatlösning.Litiumkarbonat används vid förebyggandeoch behandling av manikyrdepressivstörningar. Det används ocksåindustriellt i keramiska glasyrer.
indikationer
litium hämmar thyroidal inkorporering av I – i Tg, såväl som utsöndring av sköldkörtelhormoner, men det hämmar inte aktiviteten hos Na+-I – symporter ellerackumulering av I – inom sköldkörteln. Litium erbjuder noparticular fördel jämfört med läkemedel i tionamidklassenmen kan användas för tillfällig kontroll av tyrotoxikosispatienter som är allergiska mot både tionamideroch jodid.
varumärke
Eskalith (GlaxoSmithKline); Litan (Bayer); Litobid(JDS); Litonat (Solvay Pharmaceuticals).
allmän beskrivning
litiumkarbonat (Eskalit, Litan) och litiumcitrat(Cibalit-S) är salterna kommersiellt tillgängliga i Förenta Staterna.
Reaktivitetsprofil
en bas. Sönderdelas av syror med utvecklingen av koldioxid. Fluor brinner hårt vid kontakt med litiumkarbonat.
säkerhetsprofil
cancerframkallande data för människa. Gift genom intraperitoneala och intravenösa vägar. Måttligt giftigt vid intag och subkutana vägar. Mänskliga systemiska effekter genom intag: giftig psykos, tremor, förändringar i vätskeintag, muskelsvaghet, ökad urinvolym, illamående eller kräkningar, allergisk dermatit. Mänskliga reproduktiva effekter vid intag: effekter på nyfödda, inklusive Apgar-poängförändringar och andra neonatala åtgärder eller effekter. Mänskliga teratogena effekter genom intag: utvecklingsavvikelser i hjärt-kärlsystemet, centrala nervsystemet, muskuloskeletala och gastrointestinala system. En experimentell teratogen. Experimentella reproduktiva effekter. Experimentell carcinogenproducerande leukemi och sköldkörteltumörer. Mänskliga mutationsdata rapporterade. Används vid behandling av manisk-depressiva psykoser. Oförenlig med fluor. Se även LITIUMFÖRENINGAR.
kemisk syntes
litiumkarbonat syntetiseras genom att reagera litiumsalter med sodaeller potash, följt av rening av saltet, vilket inte är lättlösligt .
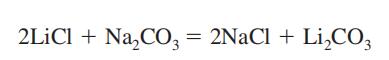
potentiell exponering
litiumkarbonat används vid behandlingav manisk-depressiva psykoser; att göra keramik och porslin glasyr; lacker, färgämnen, läkemedel, beläggning avarc-svetselektroder; batterilegeringar; nukleonik, självlysande färger; glaskeramik; smörjfett; i aluminiumproduktion
Frakt
UN2811 giftiga fasta ämnen, organiska, n.o.s., faroklass: 6.1; etiketter: 6.1-giftiga material, tekniskt namn krävs
reningsmetoder
kristallisera det från vatten. Dess löslighet minskar när temperaturen höjs. Lösligheten i H2O är 1,3% vid ~10o och 0,7% vid ~100o.
inkompatibiliteter
vattenlösningen är en stark bas.Reagerar våldsamt med syror, pulveriserat kalcium och fluor.Oförenlig med oxidationsmedel (klorater, nitrater, peroxider,permanganater, perklorater, klor, brom, fluor etc.); kontakt kan orsaka bränder eller explosioner. Håll dig bortafrån alkaliska material, Starka syror,pulveriserat kalcium, fluor, fukt. Korroderar aluminium, koppar, zink.