- carbonat de litiu proprietăți chimice, utilizări, producție
- descriere
- proprietăți chimice
- utilizări
- toxicitate
- preparat
- reacții
- proprietăți chimice
- proprietăți fizice
- utilizează
- utilizări
- utilizează
- preparat
- definiție
- indicații
- nume de marcă
- descriere generală
- profil de reactivitate
- profilul de siguranță
- sinteza chimică
- expunere potențială
- transport
- metode de purificare
- incompatibilități
carbonat de litiu proprietăți chimice, utilizări, producție
descriere
carbonat de litiu (structura moleculară este Li2CO3, denumirea engleză este carbonat de litiu) ca cristal monoclinic incolor sau pulbere albă. Densitatea este de 2,11. Punctul de topire este de 618. Fără delicvescență, este stabil în aer. Solubilitate scăzută în apă, solubilitatea scade odată cu creșterea temperaturii. Solubilitatea în apă rece este mai mare decât apa caldă. Este solubil în acid diluat, insolubil în alcool și acetonă. Dioxidul de Carbon este introdus în suspensia apoasă de carbonat de litiu, carbonatul de litiu este transformat în carbonat acid de litiu și dizolvat. Dacă soluția de carbonat acid de litiu este încălzită și apoi eliberează dioxid de carbon și precipită carbonat de litiu. Natura carbonatului de litiu poate fi utilizată pentru a îndepărta impuritățile din carbonatul de litiu. Deoarece ionul de litiu are o polarizare puternică, astfel stabilitatea termică a carbonatului de litiu este mai rea decât alte carbonat de metale alcaline, atunci când este încălzit până la punctul de topire, se va descompune pentru a produce dioxid de carbon și oxid de litiu.
proprietăți chimice
carbonatul de litiu este un solid cristalin monoclinic alb. De obicei pentru carbonați, carbonatul de litiu reacționează cu acizi mai puternici decât dioxidul de carbon sau acidul carbonic pentru a produce sarea de litiu a acidului și a dioxidului de carbon. Reacțiile pot fi efectuate într-o soluție, sub formă de suspensie apoasă sau, mai puțin eficient, cu carbonat de litiu solid.
carbonatul de litiu prezintă o solubilitate scăzută în apă pentru un carbonat de metale alcaline. Solubilitatea scade odată cu creșterea temperaturii. Nu este higroscopic și este în general stabil atunci când este expus la atmosferă. De fapt, este compusul final normal întâlnit atunci când mulți compuși de bază ai litiului sunt expuși atmosferei. Carbonatul de litiu poate fi dizolvat în apă prin conversia în carbonat acid. Eliberarea dioxidului de carbon prin încălzirea soluției de carbonat acid de litiu determină reprecipitarea carbonatului de litiu.
utilizări
industria carbonatului de litiu este o industrie globală cu monopol ridicat, capacitatea actuală de producție este concentrată în principal în trei producători străini de mp, FMC, Chemetall și așa mai departe.carbonatul de litiu Industrial este utilizat la fabricarea altor săruri de litiu, cum ar fi clorura de litiu și bromura de litiu și așa mai departe. De asemenea, acționează ca materiale de oxid de litiu în smalț, sticlă, ceramică și smalț de porțelan și este, de asemenea, adăugat la celula electrolitică pentru electroliza aluminiului pentru a crește eficiența curentă și a reduce rezistența internă a celulei și temperatura băii. În medicină, este utilizat în principal pentru tratamentul maniei, poate îmbunătăți tulburările emoționale pentru schizofrenie. Are efect de ridicare a leucocitelor periferice; poate fi utilizat pentru cauciuc sintetic, coloranți, semiconductori și industria militară de apărare și așa mai departe; pentru producția de tantalat de litiu, niobat de litiu și alte cristal acustic de calitate unică, monocristalin de calitate optică etc.; pentru prepararea cristalului unic de calitate acustică.
carbonatul de litiu de calitate a bateriei este utilizat în principal pentru prepararea oxidului de cobalt de litiu, a oxidului de mangan de litiu, a materialelor ternare, a fosfatului de fier de litiu și a altor materiale catodice ale bateriei litiu-ion; utilizat într-un modificator de matrice; ca efect aneuroprotector al carbonatului de litiu în scleroza laterală amiotrofică.
toxicitate
carbonatul de litiu are un efect stimulativ semnificativ, în primul rând are leziuni asupra tractului gastro-intestinal, rinichilor și sistemului nervos central. Ordinea de toxicitate a compușilor de litiu este Li <LiCl < Li2CO3, concentrația maximă admisibilă: condensarea litiului și aerosolul de fragmentare au fost 0,05 mg/m3 și 0,5 mg/m3.
purtați mănuși de cauciuc și măști de protecție atunci când lucrați, pentru a proteja organele respiratorii împotriva prafului.
preparat
carbonatul de litiu se obține ca produs intermediar în recuperarea litiului metalic din minereul său, spodumen (vezi litiul). Se prepară prin amestecarea unei soluții fierbinți și concentrate de carbonat de sodiu cu soluție de clorură de litiu sau sulfat.
Li2SO4+ Na2CO3 Li2co3+ Na2SO4
reacții
carbonatul de litiu reacționează cu acizii diluați, eliberând dioxidul de carbon:
Li2CO3+ HCl Li2l + CO2 + H2O
descompunerea termică produce oxid de litiu și dioxid de carbon:
Li2CO3 Li2o + CO2
reacția cu var produce hidroxid de litiu:
Li2CO3+ ca(OH)2 2lioh + CaCO3
carbonatul reacționează cu fluorura de aluminiu topită convertindu-se în fluorură de litiu:
3li2co3+ 2alf3 6lif + 3co2+ Al2O3
Se combină cu dioxidul de carbon în suspensie apoasă formând bicarbonat solubil, care se descompune în carbonat la încălzire:
Li2CO3+ CO2+ H2O 2lihco3
bicarbonatul nu poate fi separat în formă solidă. Există numai în soluție atunci când carbonatul se dizolvă în apă saturată cu Co2sub presiune.
proprietăți chimice
carbonatul de litiu este o pulbere higroscopică albă.
proprietăți fizice
cristale monoclinice albe; indice de refracție 1,428; densitate 2,11 g / cm3; se topește la 723 CTF; se descompune la 1310 CTF; solubilitate scăzută în apă (1,54 g/100 g) la 0 CTF; 1,32 g//100 g la 20 CTF); solubilitate scăzută cu temperatură (0,72 g/100 g la 100 CTF); insolubil în acetonă și etanol .
utilizează
cel mai frecvent medicament cu litiu este carbonatul de litiu, care posedă acțiune antimanie. Se presupune că litiul modifică transportul ionilor de sodiu în neuroni, influențând astfel conținutul intercelular al catecolaminelor, normalizând starea mentală și fără a provoca letargie generală. Este utilizat pentru condiții de manie de diferite origini,măsuri preventive și pentru tratarea psihozelor afective.
utilizări
carbonatul de litiu este utilizat ca compus pentru producerea metalliclitiului. Carbonatul de litiu este rezultatul tratării spodumenului mineral cu sulfuricacid și apoi adăugarea de carbonat de calciu. Este folosit ca antidepresiv.
utilizează
în producția de glazuri pe porțelan ceramic și electric.
preparat
carbonatul de litiu se prepară prin precipitarea litiumului prin ion carbonat dintr-o soluție apoasă. Încă un alt proces, care se desfășoară pe un nivel mai micscară, este reacția unei soluții de hidroxid de litiu cu gaz de dioxid de carbon. Litiumcarbonatul precipită și este recuperat din soluția supernatantă.
definiție
carbonat de litiu: un solid alb, Li2CO3; r. d.2.11; m. p. 723 CTC; se descompune peste 1310 CTC. Se produce comercial prin tratarea minereului cu acid sulfuric la 250 centimetric C și albirea produsului pentru a da o soluție de sulfat de litiu. Carbonatul este apoi obținut prin precipitatecu soluție de carbonat de sodiu.Carbonatul de litiu este utilizat în prevenireași tratamentul maniaculuitulburări depresive. De asemenea, este folositindustrial în glazuri ceramice.
indicații
litiul inhibă încorporarea tiroidiană a I-în Tg, precum și secreția hormonilor tiroidieni, dar nu inhibă activitatea na+ – i – simporter sau acumularea I-în tiroidă. Litiul oferă noparticular avantaj față de medicamentele din clasa tionamidădar poate fi utilizat pentru controlul temporar al tirotoxicozeila pacienții care sunt alergici atât la tionamide, cât și la iodură.
nume de marcă
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
descriere generală
carbonat de litiu (Eskalit, Litan) și citrat de litiu(Cibalit-S) sunt sărurile disponibile comercial în Statele Unite.
profil de reactivitate
o bază. Descompus de acizi cu evoluția dioxidului de carbon. Fluorul arde cu înverșunare la contactul cu carbonatul de litiu.
profilul de siguranță
date carcinogene la om. Otrava prin căi intraperitoneale și intravenoase. Moderat toxic prin ingestie și căi subcutanate. Efecte sistemice umane prin ingestie: psihoză toxică, tremor, modificări ale aportului de lichide, slăbiciune musculară, volum crescut de urină, greață sau vărsături, dermatită alergică. Efecte reproductive umane prin ingestie: efecte asupra nou-născutului, inclusiv modificări ale scorului Apgar și alte măsuri sau efecte neonatale. Efecte teratogene umane prin ingestie: anomalii de dezvoltare ale sistemului cardiovascular, sistemului nervos central, sistemelor musculo-scheletice și gastro-intestinale. Un teratogen experimental. Efecte reproductive experimentale. Carcinogen Experimental care produce leucemie și tumori tiroidiene. Au fost raportate date despre mutațiile umane. Utilizat în tratamentul psihozelor maniaco-depresive. Incompatibil cu fluorul. A se vedea, de asemenea, compuși de litiu.
sinteza chimică
carbonatul de litiu este sintetizat prin reacția sărurilor de litiu cu sodasau potasiu, urmată de purificarea sării, care nu este ușor solubilă .
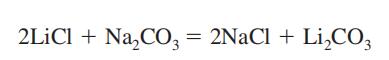
expunere potențială
carbonatul de litiu este utilizat în tratamentul psihozelor maniaco-depresive; pentru a face ceramică și glazură de porțelan; lacuri, coloranți, produse farmaceutice, acoperirea electrozilor de sudură arc; aliaje de baterii; nucleonice, vopsele luminescente; ceramică de sticlă; unsori lubrifiante; în producția de aluminiu
transport
UN2811 solide toxice, organice, n.o.s., hazardclass: 6.1; etichete: 6.1-materiale otrăvitoare, nume tehnic necesar
metode de purificare
cristalizează-l din apă. Solubilitatea sa scade odată cu creșterea temperaturii. Solubilitatea în H2O este de 1,3% la ~10o și 0,7% la ~100o.
incompatibilități
soluția apoasă este o bază puternică.Reacționează violent cu acizii, calciul sub formă de pulbere și fluorul.Incompatibil cu oxidanții (clorați, nitrați, peroxizi,permanganați, perclorați, clor, brom, fluor etc.); contactul poate provoca incendii sau explozii. Păstrați departedin materiale alcaline, acizi puternici,calciu sub formă de pulbere, fluor, umiditate. Corodează aluminiu, cupru, zinc.