- Litiumkarbonat Kjemiske Egenskaper, Bruksområder, Produksjon
- Beskrivelse
- Kjemiske Egenskaper
- Bruker
- Toksisitet
- Fremstilling
- Reaksjoner
- Kjemiske Egenskaper
- Fysiske egenskaper
- Bruker
- Bruker
- Bruker
- Forberedelse
- Definisjon
- Indikasjoner
- merkenavn
- Generell Beskrivelse
- Reaktivitetsprofil
- Sikkerhetsprofil
- Kjemisk Syntese
- Potensiell Eksponering
- Shipping
- rensemetoder
- Inkompatibilitet
Litiumkarbonat Kjemiske Egenskaper, Bruksområder, Produksjon
Beskrivelse
Litiumkarbonat (molekylær struktur Er Li2CO3, engelsk navn er litiumkarbonat) som en fargeløs monoklinisk krystall eller hvitt pulver. Tetthet er 2,11. Smeltepunktet er 618 ℃ Uten deliquescence er den stabil i luften. Lav oppløselighet i vann, oppløseligheten minker med økende temperatur. Løselighet i kaldt vann er større enn varmt vann. Det Er Løselig i fortynnet syre, uoppløselig i alkohol og aceton. Kullsyre blir introdusert i den vandige suspensjonen av litiumkarbonat, litiumkarbonat omdannes til litiumsyrekarbonat og oppløses. Hvis løsningen av litiumsyrekarbonat oppvarmes, frigjør det karbondioksid og utfeller litiumkarbonat. Naturen til litiumkarbonatet kan brukes til å fjerne urenheter fra litiumkarbonat. Siden litiumion har en sterk polariserbarhet, er termisk stabilitet av litiumkarbonat verre enn annet alkalimetallkarbonat, når det oppvarmes til over smeltepunktet, vil det dekomponere for å produsere karbondioksid og litiumoksid.
Kjemiske Egenskaper
Litiumkarbonat er et hvitt monoklinisk krystallinsk fast stoff. Typisk for karbonater reagerer litiumkarbonat med syrer sterkere enn karbondioksid eller karbonsyre for å gi litiumsaltet av syren og karbondioksidet. Reaksjonene kan utføres i en oppløsning, som en vandig slurry, eller, mindre effektivt, med fast litiumkarbonat.
Litiumkarbonat utviser en lav vannløselighet for et alkalimetallkarbonat. Oppløseligheten minker med økende temperatur. Det er ikke hygroskopisk og er generelt stabilt når det utsettes for atmosfæren. Faktisk er det den normale endeforbindelsen som oppstår når mange grunnleggende litiumforbindelser blir utsatt for atmosfæren. Litiumkarbonat kan oppløses i vann ved omdannelse til hydrogenkarbonatet. Utslipp av karbondioksid ved oppvarming av løsningen av litiumhydrogenkarbonat forårsaker reprecipitering av litiumkarbonatet.
Bruker
litiumkarbonatindustrien er en global høy monopolindustri, den nåværende produksjonskapasiteten er hovedsakelig konsentrert i tre utenlandske produsenter AV KVM, FMC, Chemetall og så videre.
Industrielt litiumkarbonat brukes til fremstilling av andre litiumsalter, som litiumklorid og litiumbromid og så videre. Det virker også som litiumoksidmaterialer i emalje, glass, keramikk og porselen emalje, og det legges også til elektrolytisk celle for elektrolyse av aluminium for å øke dagens effektivitet og redusere den indre motstanden til cellen og badetemperaturen. I medisin brukes den hovedsakelig til behandling av mani, kan forbedre deres følelsesmessige lidelser for schizofreni. Det har effekten av å heve perifere leukocytter; kan brukes til syntetisk gummi, fargestoffer, halvleder og militærforsvarsindustri og så videre; for produksjon av litiumtantalat, litium niobat og annen akustisk klasse enkeltkrystall, optisk klasse monokrystallinsk etc; for forberedelse av akustisk klasse enkeltkrystall. Litiumkarbonat av Litiumkvalitet brukes hovedsakelig til fremstilling av litiumkoboltoksid, litiummanganoksyd, ternære materialer, litiumjernfosfat og andre litiumionbatterikatodematerialer; brukt i en matriksmodifikator; som aneuroprotective effekt av litiumkarbonat i amyotrofisk lateral sklerose.
Toksisitet
Litiumkarbonat har en betydelig stimulerende effekt, for det første har skade på mage-tarmkanalen, nyre og sentralnervesystemet. Toksisitet rekkefølge av litium forbindelser Er Li <LiCl <Li2CO3, maksimal tillatt konsentrasjon: Litiumkondensasjon og fragmentering aerosol var 0,05 mg/m3 og 0,5 mg/m3.
bruk gummihansker og beskyttende masker når du arbeider, for å beskytte luftveiene mot støv.
Fremstilling
Litiumkarbonat oppnås som et mellomprodukt ved gjenvinning av litiummetall fra malmen, spodumen (Se Litium). Den fremstilles ved å blande en varm og konsentrert løsning av natriumkarbonat med litiumklorid eller sulfatoppløsning.
Li2SO4 + Na2CO3→Li2CO3 + Na2SO4
Reaksjoner
Litiumkarbonat reagerer med fortynnede syrer, frigjørende karbondioksid:
Li2CO3+ HCl →LiCl + CO2+ H2O
Termisk dekomponering gir litiumoksid og karbondioksid:
Li2CO3 → Li2O + CO2
Reaksjon med kalk produserer litiumhydroksid:
Li2CO3 + Ca(OH) 2→2lioh + CaCO3
karbonatet reagerer med smeltet aluminiumfluorid konvertering til litiumfluorid:
3Li2CO3+ 2alf3 → 6LiF + 3co2 + Al2O3
den kombinerer med karbondioksid i vandig slurry som danner løselig bikarbonat, som dekomponerer til karbonat ved oppvarming:
Li2CO3+ CO2+ H2O →2lihco3
bikarbonatet kan ikke skilles i fast form. Den eksisterer bare i oppløsning når karbonat oppløses i vann mettet Med CO2under trykk.
Kjemiske Egenskaper
Litiumkarbonat er et hvitt hygroskopisk pulver.
Fysiske egenskaper
Hvite monokliniske krystaller; brytningsindeks 1.428; tetthet 2.11 g/cm3; smelter ved 723°C; dekomponerer ved 1.310°C; lav oppløselighet i vann (1.54 g/100g) ved 0°C; 1.32 g//100g ved 20°C), oppløselighet reduseres med temperatur (0.72 g/100g ved 100°C); uoppløselig i aceton og etanol.
Bruker
det vanligste litiummedikamentet er litiumkarbonat, som har antimania-virkning. Detdet antas at litium endrer transporten av natriumioner i nevroner, og dermed påvirkerdet intercellulære innholdet av katekolaminer, normaliserer mental tilstand og ikke forårsakergenerell sløvhet. Den brukes for mani forhold av forskjellig opprinnelse, forebyggende tiltak, og for behandling av affektive psykoser.
Bruker
Litiumkarbonat brukes som en forbindelse for å produsere metalliclithium. Litiumkarbonat er et resultat av behandling av mineralspodumet med svovelsyre og deretter tilsetning av kalsiumkarbonat. Det brukes som et antidepressivt middel.
Bruker
i produksjon av glasur på keramisk og elektrisk porselen.
Forberedelse
Litiumkarbonat fremstilles ved utfelling av litiumion med karbonation fra en vandig løsning. Enda en annen prosess, som utføres på en mindreskala, er reaksjonen av en løsning av litiumhydroksyd med karbondioksidgass. Lithiumcarbonate utfelles og gjenvinnes fra supernatant-løsningen.
Definisjon
litiumkarbonat: et hvitt fast stoff, Li2CO3; r.d. 2.11; m. p. 723°C; dekomponerer over 1310°C. Det produseres kommersielt ved å behandle malmen med svovelsyre ved 250°C og vaske produktet for å gi en løsning av litiumsulfat. Karbonateter deretter oppnådd ved utfellingmed natriumkarbonatløsning.Litiumkarbonat brukes i forebyggingog behandling av manicdepressivforstyrrelser. Den brukes ogsåindustrielt i keramiske glasur.
Indikasjoner
Litium hemmer tyreoidal inkorporering av I-i Tg, så vel som utskillelsen av skjoldbruskhormoner, men det hemmer ikke Aktiviteten Til Na+-i – symporteren eller akkumuleringen av I – i skjoldbruskkjertelen. Litium gir noopartikulær fordel over legemidler av thionamid-klassen, men kan brukes til midlertidig kontroll av tyrotoksikosehos pasienter som er allergiske mot både thionamid og jodid.
Eskalith (GlaxoSmithKline); Litan (Bayer); Litobid (JDS); Litonat (Solvay Pharmaceuticals).
Generell Beskrivelse
Litiumkarbonat(Eskalith, Litan) og litiumcitrat (Cibalith-S) er saltene som er kommersielt tilgjengelige i usa.
Reaktivitetsprofil
en base. Dekomponert av syrer med utviklingen av karbondioksid. Fluor brenner sterkt ved kontakt Med Litiumkarbonat.
Sikkerhetsprofil
humane karsinogene data. Gift ved intraperitoneale og intravenøse veier. Moderat giftig ved inntak og subkutane veier. Humane systemiske effekter ved inntak: giftig psykose, tremor, endringer i væskeinntak, muskel svakhet, økt urinvolum, kvalme eller oppkast, allergisk dermatitt. Effekter på nyfødte, inkludert Apgar score endringer og andre neonatal tiltak eller effekter. Humane teratogene effekter ved inntak: utviklingsmessige abnormiteter i kardiovaskulærsystemet, sentralnervesystemet, muskuloskeletale og gastrointestinale systemer. Et eksperimentelt teratogen. Eksperimentelle reproduktive effekter. Eksperimentell karsinogen produserer leukemi og skjoldbrusk svulster. Menneskelige mutasjonsdata rapportert. Brukes til behandling av manisk-depressive psykoser. Uforenlig med fluor. SE OGSÅ LITIUMFORBINDELSER.
Kjemisk Syntese
Litiumkarbonat syntetiseres ved å reagere litiumsalter med sodaeller potash, etterfulgt av rensing av saltet, som ikke er lettoppløselig .
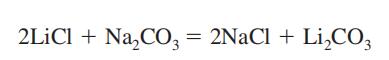
Potensiell Eksponering
Litiumkarbonat brukes i behandlingav manisk-depressive psykoser; for å lage keramikk og porselen glasur; lakk, fargestoffer, legemidler, belegg avarc-sveiseelektroder; batteri legeringer; nukleonikk, luminescerende maling; glasskeramikk; smørefett; i aluminiumproduksjon
Shipping
UN2811 Giftige faste stoffer, organisk, nos, hazardclass: 6.1; labels: 6.1-giftige materialer, technicalname kreves
rensemetoder
krystallisere Det fra vann. Dens oppløselighet avtar når temperaturen heves. Oppløseligheten I H2O er 1,3% ved ~10o og 0,7% ved ~100o.
Inkompatibilitet
den vandige oppløsningen er en sterk base.Reagerer voldsomt med syrer, pulverisert kalsium og fluor.Uforenlig med oksidasjonsmidler (klorater, nitrater, peroksider,permanganater, perklorater, klor, brom, fluor,etc.); kontakt kan forårsake brann eller eksplosjoner. Hold deg unnafra alkaliske materialer, sterke syrer, pulverisert kalsium, fluor, fuktighet. Korroderer aluminium, kobber, sink.