carbonato de lítio propriedades químicas, utilizações, produção
Descrição
carbonato de lítio (a estrutura molecular é Li2CO3, o nome Inglês é carbonato de lítio) como um cristal monoclínico incolor ou pó branco. Densidade: 2,11. O ponto de fusão é 618 ℃. Sem deliquescência, é estável no ar. Baixa solubilidade na água, a solubilidade diminui com o aumento da temperatura. A solubilidade em água fria é maior do que a água quente. É solúvel em ácido diluído, insolúvel em álcool e acetona. O dióxido de carbono é introduzido na suspensão aquosa de carbonato de lítio, carbonato de lítio é convertido em carbonato ácido de lítio e dissolvido. Se a solução de carbonato ácido de lítio é aquecida e então liberta dióxido de carbono e precipita carbonato de lítio. A natureza do carbonato de lítio pode ser usado para remover impurezas do carbonato de lítio. Uma vez que o íon de lítio tem uma forte polarizabilidade, assim a estabilidade térmica do carbonato de lítio é pior do que outros carbonatos metálicos alcalinos, quando aquecidos acima do ponto de fusão, ele se decompõe para produzir dióxido de carbono e óxido de lítio.
propriedades químicas
carbonato de lítio é um sólido cristalino monoclínico branco. Tipicamente para carbonatos, carbonato de lítio reage com ácidos mais fortes do que dióxido de carbono ou ácido carbônico para produzir o sal de lítio do ácido e dióxido de carbono. As reações podem ser realizadas em uma solução, como uma suspensão aquosa, ou, menos efetivamente, com carbonato de lítio sólido.carbonato de lítio exibe uma baixa solubilidade em água para um carbonato de metal alcalino. A solubilidade diminui com o aumento da temperatura. Não é higroscópico e é geralmente estável quando exposto à atmosfera. Na verdade, é o composto final normal encontrado quando muitos compostos básicos de lítio são expostos à atmosfera. Carbonato de lítio pode ser dissolvido em água por conversão para o hidrogenocarbonato. Liberando dióxido de carbono aquecendo a solução de hidrogenocarbonato de lítio causa reprecipitação do carbonato de lítio. a indústria de carbonato de lítio é uma indústria global de alto monopólio, a capacidade de produção atual está concentrada principalmente em três fabricantes estrangeiros de SQM, FMC, Chemetall e assim por diante.carbonato de lítio Industrial é usado na fabricação de outros sais de lítio, tais como cloreto de lítio e brometo de lítio e assim por diante. Ele também atua como materiais de óxido de lítio em esmalte, vidro, cerâmica e esmalte de porcelana, e também é adicionado à célula eletrolítica para eletrólise de alumínio para aumentar a eficiência atual e reduzir a resistência interna da célula e da temperatura do banho. Na medicina, é usado principalmente para o tratamento da mania, pode melhorar seus transtornos emocionais para a esquizofrenia. Ele tem o efeito de elevar os leucócitos periféricos; pode ser usado para borracha sintética, corantes, Semicondutores e indústria de defesa militar e assim por diante; for the production of lithium tantalate, lithium niobate and other acoustic grade single crystal, optical grade monocristaline etc; for preparation of the acoustic grade single crystal. carbonato de lítio de grau bateria é usado principalmente para a preparação de óxido de lítio cobalto, óxido de lítio manganês, materiais ternários, fosfato de lítio ferro e outros materiais catódicos de bateria de iões de lítio; usado em um modificador de matriz; como um efeito europrotetor do carbonato de lítio na esclerose lateral amiotrófica. o carbonato de lítio tem um efeito estimulante significativo, em primeiro lugar tem danos no tracto gastrointestinal, rim e sistema nervoso central. A ordem de toxicidade dos compostos de lítio é Li <LiCl <Li2CO3, concentração máxima admissível: condensação de lítio e aerossol de fragmentação foram 0,05 mg/m3 e 0,5 mg/m3.usar luvas de borracha e máscaras de protecção durante o trabalho, a fim de proteger os órgãos respiratórios contra o pó. o carbonato de lítio é obtido como um produto intermediário na recuperação do metal de lítio a partir do seu minério, o espodumeno (ver lítio). É preparado misturando uma solução quente e concentrada de carbonato de sódio com cloreto de lítio ou solução de sulfato.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
Reações
carbonato de Lítio reage com ácidos diluídos, liberando dióxido de carbono:
Li2CO3+ HCl →LiCl + CO2+ H2O
Térmica decompostion rendimentos de óxido de lítio e dióxido de carbono:
Li2CO3 → Li2O + CO2
Reação com a cal produz hidróxido de lítio:
Li2CO3+ Ca(OH)2→2LiOH + CaCO3
carbonato de cálcio reage com o alumínio fundido fluoreto de conversão para o fluoreto de lítio:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
se combina com o dióxido de carbono na lama aquosa formando bicarbonato solúvel, que se decompõe para carbonato após o aquecimento:
Li2CO3+ CO2+ H2O →2LiHCO3
O bicarbonato não podem ser separados na forma sólida. Existe apenas em solução quando o carbonato se dissolve em água saturada com pressão de CO2under. o carbonato de lítio é um pó higroscópico branco.
propriedades Físicas
Branco monoclinic cristais; índice de refração 1.428; densidade 2.11 g/cm3; derrete-se a 723°C; decompõe-se a 1,310°C; baixa solubilidade em água (1.54 g/100g) a 0°C; 1.32 g//100g a 20°C), a solubilidade diminui com a temperatura (de 0,72 g/100g a 100°C; insolúvel em acetona e em etanol.
usa
a droga de lítio mais comum é carbonato de lítio, que possui ação antimania. Presume-se que o lítio altera o transporte de iões de sódio nos neurónios, influenciando assim o conteúdo intercelular das catecolaminas, normalizando o estado mental e não causando letargia geral. É usado para condições de mania de várias origens, medidas preventivas, e para o tratamento de psicoses afetivas. o carbonato de lítio é usado como um composto para a produção de metaliclítio. Carbonato de lítio é o resultado de tratar o espodumeno mineral com sulfuricácido e, em seguida, adicionar carbonato de cálcio. É usado como antidepressivo.
utiliza
na produção de vidros em Porcelana Cerâmica e elétrica. o carbonato de lítio é preparado pela precipitação de litiumião por ião carbonatado a partir de uma solução aquosa. Ainda outro processo, que é realizado em uma escala mais pequena, é a reação de uma solução de hidróxido de lítio com gás dióxido de carbono. O litiumcarbonato precipita-se e é recuperado da solução sobrenadante. carbonato de lítio: um sólido branco, Li2CO3; R. D. 2.11; M. P. 723 ° c; decomposição superior a 1310 ° C. É produzido comercialmente por tratamento do minério com ácido sulfúrico a 250°C e por lixiviação do produto para obter uma solução de sulfato de lítio. O carbonato é então obtido por precipitação com a solução de carbonato de sódio.Carbonato de lítio é usado na prevenção e tratamento de gravadores de manicômios. É também utilizado industrialmente em vidraças cerâmicas.
indicações
o lítio inibe a incorporação tiroidal de I-em Tg, bem como a secreção de hormonas tiroideias, mas não inibe a actividade do simportador na+-i ou a acumulação de I – na tiróide. O lítio oferece uma vantagem noparticular sobre os medicamentos da classe da thionamida, mas pode ser utilizado para o controlo temporário da tirotoxicosis em doentes alérgicos tanto à tionamida como ao iodeto.
marca
Eskalith (GlaxoSmithKline); Lithane(Bayer); Lithobid (JDS); Lithonate (Solvay Pharmaceuticals).
Descrição geral
Litiumcarbonato (Eskalith, Lithane) e citrato de lítio(Cibalith-s) são os sais comercialmente disponíveis nos Estados Unidos.
perfil de reactividade
uma base. Decomposto por ácidos com a evolução do dióxido de carbono. O flúor queima ferozmente em contacto com carbonato de lítio. dados carcinogénicos para o homem . Veneno por via intraperitoneal e intravenosa. Moderadamente tóxico por ingestão e Via subcutânea. Efeitos sistémicos humanos por ingestão: psicose tóxica, tremores, alterações na ingestão de líquidos, fraqueza muscular, aumento do volume de urina, náuseas ou vómitos, dermatite alérgica. Efeitos na reprodução humana por ingestão: efeitos no recém-nascido, incluindo alterações na pontuação Apgar e outras medidas ou efeitos neonatais. Efeitos teratogénicos humanos por ingestão: anomalias no desenvolvimento do sistema cardiovascular, do sistema nervoso central, dos sistemas músculo-esquelético e gastrointestinal. Um teratógeno experimental. Efeitos reprodutivos experimentais. Carcinógeno Experimental produzindo leucemia e tumores da tiróide. Dados de mutação humana relatados. Utilizado no tratamento de psicoses maníaco-depressivas. Incompatível com flúor. Ver também compostos de lítio. o carbonato de lítio é sintetizado reagindo sais de lítio com potassa sodaor, seguido pela purificação do sal, que não é facilmente solúvel .
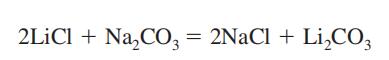
Potencial de Exposição
o carbonato de Lítio é usado em treatmentof maníaco-depressiva psicoses; para fazer cerâmica e porcelana de esmalte; vernizes, corantes, produtos farmacêuticos, revestimento ofarc-soldagem de eletrodos da bateria; ligas; nucleonics, tintas luminescentes; vidro cerâmica; lubrificantes graxas; na produção de alumínio
Transporte
UN2811 sólidos Tóxicos, orgânicos, n.o.s., HazardClass: 6.1; Etiquetas: 6.1-materiais Venenosos, TechnicalName Necessário
de Purificação de Métodos
Cristalizar-lo da água. Sua solubilidade diminui à medida que a temperatura é elevada. A solubilidade em H2O é de 1,3% a ~10o, e de 0,7% a ~100o.
incompatibilidades
a solução aquosa é uma base forte.Reage violentamente com ácidos, cálcio em pó e flúor.Incompatíveis com oxidantes (cloratos, nitratos, peróxidos,permanganatos, Percloratos, cloro, bromo, flúor,etc.); o contato pode causar incêndios ou explosões. Manter afastado de materiais alcalinos, ácidos fortes, cálcio em pó, flúor, Humidade. Corrói alumínio, cobre, zinco.