- uhličitan lithný Chemické Vlastnosti,Použití,Výroby
- Popis
- Chemické Vlastnosti
- Použití
- toxicita
- přípravek
- Reakce
- chemické vlastnosti
- Fyzikální vlastnosti
- používá
- použití
- používá
- přípravek
- Definice
- Označení
- obchodní značka
- obecný popis
- reaktivita profil
- bezpečnostní profil
- Chemická syntéza
- Potenciální Expozice
- Doprava
- Metody Čištění
- Inkompatibility
uhličitan lithný Chemické Vlastnosti,Použití,Výroby
Popis
uhličitan lithný (molekulární struktura je Li2CO3, anglický název je uhličitan lithný) jako bezbarvý monoclinic krystaly nebo bílý prášek. Hustota je 2,11. Teplota tání je 618 ℃. Bez deliquescence je stabilní ve vzduchu. Nízká rozpustnost ve vodě, rozpustnost klesá s rostoucí teplotou. Rozpustnost ve studené vodě je větší než horká voda. Je rozpustný ve zředěné kyselině, nerozpustný v alkoholu a acetonu. Oxid uhličitý se zavádí do vodné suspenze uhličitanu lithného, uhličitan lithný se převede na uhličitan lithný a rozpustí se. Pokud se roztok uhličitanu kyseliny lithné zahřeje a poté uvolní oxid uhličitý a vysráží uhličitan lithný. Povaha uhličitanu lithného může být použita k odstranění nečistot z uhličitanu lithného. Vzhledem k tomu, lithium ion má silný polarizability, tedy tepelné stability uhličitan lithný je horší než jiné uhličitany alkalických kovů, při zahřátí nad bod tání, že se rozkládají na oxid uhličitý a lithium-oxid.
Chemické Vlastnosti
uhličitan lithný je bílá monoclinic krystalické pevné látky. Typicky pro uhličitany, uhličitan lithný reaguje s kyselinami silnějšími než oxid uhličitý nebo kyselina uhličitá za vzniku lithiové soli kyseliny a oxidu uhličitého. Reakce mohou být prováděny v roztoku, jako vodná suspenze, nebo, méně účinně, s pevným uhličitanem lithným.
uhličitan lithný vykazuje nízkou rozpustnost ve vodě pro uhličitan alkalických kovů. Rozpustnost klesá s rostoucí teplotou. Není hygroskopický a je obecně stabilní, když je vystaven atmosféře. Ve skutečnosti je to normální koncová sloučenina, se kterou se setkáváme, když je mnoho základních sloučenin lithia vystaveno atmosféře. Uhličitan lithný může být rozpuštěn ve vodě přeměnou na hydrogenuhličitan. Uvolňování oxidu uhličitého zahřátím roztoku hydrogenuhličitanu lithného způsobuje opakovanou recipitaci uhličitanu lithného.
Použití
uhličitan lithný průmysl je globální vysoké monopol průmyslu, současná výrobní kapacita je soustředěna především na tři zahraniční výrobci SQM, FMC, Chemetall, a tak dále.
průmyslový uhličitan lithný se používá při výrobě jiných solí lithia, jako je chlorid lithný a bromid lithný atd. Působí také jako lithium oxid materiálů v smaltu, skla, keramiky a porcelánu smalt, a to je také přidána do elektrolytické cely pro elektrolýzu hliníku pro zvýšení proudu účinnost a snížit vnitřní odpor buňky a teplota lázně. V medicíně se používá hlavně k léčbě mánie, může zlepšit jejich emoční poruchy pro schizofrenii. Má za následek zvýšení periferních leukocytů; lze použít pro syntetický kaučuk, barviva, polovodičový a vojenský obranný průmysl atd; pro výrobu lithio-tantalové, lithiumniobové a další akustické třídě jednoho krystalu, optická třída monokrystalického atd.; pro přípravu akustické třídě jeden krystal.
Baterie stupeň uhličitan lithný se používá především pro přípravu lithium oxidu kobaltu, lithia oxid manganatý, ternární materiály, lithium železo fosfátu a dalších lithium-iontová baterie katodové materiály; použít v matrici modifikátor; jako aneuroprotective účinek uhličitanu lithného v amyotrofická laterální skleróza.
toxicita
uhličitan lithný má významný stimulační účinek, nejprve má poškození gastrointestinálního traktu, ledvin a centrálního nervového systému. Toxicita aby lithiových sloučenin je-Li <LiCl <Li2CO3, maximální přípustná koncentrace: Lithium-kondenzace a fragmentace aerosolu byly 0,05 mg/m3 a 0,5 mg/m3.
Při práci používejte gumové rukavice a ochranné masky, abyste chránili dýchací orgány před prachem.
přípravek
uhličitan lithný se získává jako meziprodukt při regeneraci lithného kovu z jeho rudy, spodumenu(viz Lithium). Připravuje se smícháním horkého a koncentrovaného roztoku uhličitanu sodného s roztokem chloridu lithného nebo síranu.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
Reakce
Lithium uhličitan reaguje s ředění kyselin, uvolňování oxidu uhličitého:
Li2CO3+ HCl →LiCl + CO2+ H2O
Tepelná decompostion výnosy lithium oxidu dusnatého a oxidu uhličitého:
Li2CO3 → Li2O + CO2
Reakce s vápnem vytváří hydroxid lithný:
Li2CO3+ Ca(OH)2→2LiOH + CaCO3
uhličitan reaguje s roztaveným hliníkem fluorid konverze na fluorid lithný:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
To kombinuje s oxidem uhličitým ve vodné suspenzi tvoří rozpustný hydrogenuhličitan, který se rozkládá na uhličitan na vytápění:
Li2CO3+ CO2+ H2O →2LiHCO3
hydrogenuhličitan nemohou být odděleny v pevné formě. Existuje pouze v roztoku, když se uhličitan rozpustí ve vodě nasycené CO2 pod tlakem.
chemické vlastnosti
uhličitan lithný je bílý hygroskopický prášek.
Fyzikální vlastnosti
Bílá monoclinic krystaly; index lomu 1.428; hustota 2.11 g/cm3, taje při 723°C, rozkládá se na 1,310°C; nízká rozpustnost ve vodě (1.54 g/100 g) při 0°C; 1.32 g/100g při 20°C) rozpustnost klesá s teplotou (0.72 g/100 g při 100°C); nerozpustný v acetonu a etanolu.
používá
nejběžnějším lithiovým léčivem je uhličitan lithný, který má antimanický účinek. Je předpokládá se, že lithium mění transport sodíkových iontů v neuronech, tak influencingthe mezibuněčné obsah katecholaminů, normalizuje duševní stav a ne causinggeneral letargie. Používá se pro stavy mánie různého původu, preventivní opatření a pro léčbu afektivních psychóz.
použití
uhličitan lithný se používá jako sloučenina pro výrobu metalliclithia. Uhličitan lithný je výsledkem zpracování minerálního spodumenu síroukyselinou a následným přidáním uhličitanu vápenatého. Používá se jako antidepresivum.
používá
při výrobě glazur na keramickém a elektrickém porcelánu.
přípravek
uhličitan lithný se připravuje srážením lithiumionu uhličitanovým iontem z vodného roztoku. Ještě další proces, který se provádí na smallerscale, je reakce roztoku hydroxidu lithného s oxidem siřičitým. Lithiumkarbonát se vysráží a získává se z roztoku supernatantu.
Definice
uhličitan lithný: bílé pevné látky,Li2CO3; r.d. 2.11; m.p. 723°C; decomposesabove 1310°C. Vyrábí se komerčně zpracováním rudy kyselinou sírovou při teplotě 250°C a odstraněním produktu za vzniku roztoku síranu lithného. Uhličitanse pak získá vysráženíms roztokem uhličitanu sodného.Uhličitan lithný se používá při prevencia léčba manických depresíporuchy. Používá se také v keramických glazurách.
Označení
Lithium inhibuje štítné žlázy začlenění do Tg, stejně jako sekreci hormonů štítné žlázy, ale to doesnot inhibují aktivitu Na+-jsem – symportér nebo theaccumulation I – v rámci štítné žlázy. Lithium nenabízí žádnou výhodu oproti lékům třídy thionamidale mohou být použity pro dočasnou kontrolu pacientů s tyreotoxikózou, kteří jsou alergičtí na thionamidy a jodid.
obchodní značka
Eskalit (GlaxoSmithKline); Lithan (Bayer); Lithobid(JDS); Litonát (Solvay Pharmaceuticals).
obecný popis
Lithiumuhličitan (Eskalit, Lithan) a citrát lithný (Cibalith-S)jsou soli komerčně dostupné ve Spojených státech.
reaktivita profil
báze. Rozkládá se kyselinami s vývojem oxidu uhličitého. Fluor při kontaktu s uhličitanem lithným prudce hoří.
bezpečnostní profil
údaje týkající se karcinogenity u člověka. Jed intraperitoneální a intravenózní cestou. Středně toxický při požití a subkutánním podání. Lidské systémové účinky při požití: toxická psychóza, třes, změny příjmu tekutin, svalová slabost, zvýšený objem moči, nevolnost nebo zvracení, alergická dermatitida. Účinky na reprodukci u člověka při požití: účinky na novorozence, včetně změn skóre Apgar a dalších novorozeneckých opatření nebo účinků. Lidské teratogenní účinky při požití: vývojové abnormality kardiovaskulárního systému, centrálního nervového systému, muskuloskeletálního a gastrointestinálního systému. Experimentální teratogen. Experimentální reprodukční účinky. Experimentální karcinogen produkující leukémii a nádory štítné žlázy. Hlášeny údaje o lidských mutacích. Používá se při léčbě maniodepresivní psychózy. Nekompatibilní s fluorem. Viz také sloučeniny lithia.
Chemická syntéza
uhličitan lithný se syntetizuje reakcí solí lithia se sodounebo potašem, následované čištěním soli, která není snadno rozpustná .
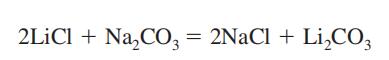
Potenciální Expozice
uhličitan lithný se používá při léčbě maniodepresivní psychózy; aby se keramiky a porcelánu glazury; laky, barviva, léčiva, nátěrové ofarc-svařovací elektrody; baterie slitin; nucleonics, luminiscenční barvy; sklokeramika; mazací tuky; v výroba hliníku
Doprava
UN2811 Toxic pevných látek, organic, n.o.s., HazardClass: 6.1; Štítky: 6.1-Jedovaté materiály, TechnicalName Požadované
Metody Čištění
Krystalizaci z vody. Jeho rozpustnost klesá se zvyšující se teplotou. Rozpustnost v H2O je 1,3% při ~10o a 0,7% při ~100o.
Inkompatibility
vodný roztok je silná báze.Prudce reaguje s kyselinami, práškovým vápníkem a fluorem.Nekompatibilní s oxidačními činidly (chlorečnany, dusičnany,peroxidy, manganistany, chloristany, chlor, brom,fluor atd.); kontakt může způsobit požáry nebo výbuchy. Uchovávejte dálz alkalických materiálů, silných kyselin, práškového vápníku, fluoru, vlhkosti. Koroduje hliník, měď, zinek.