- Propriétés chimiques du carbonate de lithium, utilisations, Production
- Description
- Propriétés chimiques
- Utilisations
- Toxicité
- Préparation
- Réactions
- Propriétés chimiques
- Propriétés physiques
- Utilisations
- Utilisations
- Utilise
- Préparation
- Définition
- Indications
- marque
- Description générale
- Profil de réactivité
- Profil de sécurité
- Synthèse chimique
- Exposition potentielle
- Expédition
- Les méthodes de purification
- Incompatibilités
Propriétés chimiques du carbonate de lithium, utilisations, Production
Description
Carbonate de lithium (la structure moléculaire est Li2CO3, le nom anglais est le carbonate de lithium) sous forme de cristal monoclinique incolore ou de poudre blanche. La densité est de 2,11. Le point de fusion est de 618 ℃. Sans déliquescence, il est stable dans l’air. Faible solubilité dans l’eau, la solubilité diminue avec l’augmentation de la température. La solubilité dans l’eau froide est supérieure à celle de l’eau chaude. Il est soluble dans l’acide dilué, insoluble dans l’alcool et l’acétone. Le dioxyde de carbone est introduit dans la suspension aqueuse de carbonate de lithium, le carbonate de lithium est converti en carbonate acide de lithium et dissous. Si la solution de carbonate d’acide de lithium est chauffée, elle libère du dioxyde de carbone et précipite le carbonate de lithium. La nature du carbonate de lithium peut être utilisée pour éliminer les impuretés du carbonate de lithium. Étant donné que l’ion lithium a une forte polarisabilité, la stabilité thermique du carbonate de lithium est donc pire que celle des autres carbonate de métal alcalin, lorsqu’il est chauffé au-dessus du point de fusion, il se décompose pour produire du dioxyde de carbone et de l’oxyde de lithium.
Propriétés chimiques
Le carbonate de lithium est un solide cristallin monoclinique blanc. Typiquement pour les carbonates, le carbonate de lithium réagit avec des acides plus forts que le dioxyde de carbone ou l’acide carbonique pour donner le sel de lithium de l’acide et du dioxyde de carbone. Les réactions peuvent être effectuées en solution, sous forme de suspension aqueuse, ou, de manière moins efficace, avec du carbonate de lithium solide.
Le carbonate de lithium présente une faible solubilité dans l’eau pour un carbonate de métal alcalin. La solubilité diminue avec l’augmentation de la température. Il n’est pas hygroscopique et est généralement stable lorsqu’il est exposé à l’atmosphère. En fait, c’est le composé final normal rencontré lorsque de nombreux composés basiques du lithium sont exposés à l’atmosphère. Le carbonate de lithium peut être dissous dans l’eau par conversion en hydrogénocarbonate. La libération de dioxyde de carbone par chauffage de la solution d’hydrogénocarbonate de lithium provoque la reprécipitation du carbonate de lithium.
Utilisations
L’industrie du carbonate de lithium est une industrie mondiale à haut monopole, la capacité de production actuelle est principalement concentrée dans trois fabricants étrangers de SQM, FMC, Chemetall, etc.
Le carbonate de lithium industriel est utilisé dans la fabrication d’autres sels de lithium, tels que le chlorure de lithium et le bromure de lithium, etc. Il agit également comme matériaux d’oxyde de lithium dans l’émail, le verre, la poterie et l’émail de porcelaine, et il est également ajouté à la cellule électrolytique pour l’électrolyse de l’aluminium afin d’augmenter l’efficacité du courant et de réduire la résistance interne de la cellule et la température du bain. En médecine, il est principalement utilisé pour le traitement de la manie, peut améliorer leurs troubles émotionnels pour la schizophrénie. Il a pour effet d’élever les leucocytes périphériques; peut être utilisé pour le caoutchouc synthétique, les colorants, les semi-conducteurs et l’industrie de la défense militaire, etc.; pour la production de tantalate de lithium, de niobate de lithium et d’autres monocristaux de qualité acoustique, monocristallins de qualité optique, etc.; pour la préparation du monocristal de qualité acoustique.
Le carbonate de lithium de catégorie de batterie est principalement employé pour la préparation de l’oxyde de cobalt de lithium, de l’oxyde de manganèse de lithium, des matériaux ternaires, du phosphate de fer de lithium et d’autres matériaux de cathode de batterie d’ion de lithium ; utilisé dans un modificateur de matrice ; comme effet aneuroprotecteur du carbonate de lithium dans la sclérose latérale amyotrophique.
Toxicité
Le carbonate de lithium a un effet stimulant significatif, a d’abord des dommages sur le tractus gastro-intestinal, les reins et le système nerveux central. L’ordre de toxicité des composés du lithium est Li<LiCl < Li2CO3, concentration maximale admissible: Les aérosols de condensation et de fragmentation du lithium étaient de 0,05 mg / m3 et de 0,5 mg/m3.
Portez des gants en caoutchouc et des masques de protection lorsque vous travaillez, afin de protéger les organes respiratoires contre la poussière.
Préparation
Le carbonate de lithium est obtenu comme produit intermédiaire dans la récupération du lithium métal à partir de son minerai, le spodumène (voir Lithium). Il est préparé en mélangeant une solution chaude et concentrée de carbonate de sodium avec une solution de chlorure de lithium ou de sulfate.
Li2SO4 + Na2CO3 → Li2CO3 + Na2SO4
Réactions
Le carbonate de lithium réagit avec les acides dilués, libérant du dioxyde de carbone:
Li2CO3 + HCl → LiCl + CO2 + H2O
La décomposition thermique donne de l’oxyde de lithium et du dioxyde de carbone:
Li2CO3 → Li2O + CO2
La réaction avec la chaux produit de l’hydroxyde de lithium:
Li2CO3 + Ca (OH) 2 → 2LiOH + CaCO3
Le carbonate réagit avec le fluorure d’aluminium fondu se convertissant en fluorure de lithium:
3Li2CO3 + 2AlF3 → 6LiF + 3CO2 + Al2O3
Il se combine avec du dioxyde de carbone dans une suspension aqueuse formant du bicarbonate soluble, qui se décompose en carbonate lors du chauffage:
Li2CO3 + CO2 + H2O → 2LiHCO3
Le bicarbonate ne peut pas être séparé sous forme solide. Il n’existe qu’en solution lorsque le carbonate se dissout dans de l’eau saturée de CO2 sous pression.
Propriétés chimiques
Le carbonate de lithium est une poudre hygroscopique blanche.
Propriétés physiques
Cristaux monocliniques blancs; indice de réfraction 1,428; densité 2,11 g / cm3; fond à 723 ° C; se décompose à 1 310 ° C; faible solubilité dans l’eau (1,54 g / 100g) à 0 ° C; 1,32 g / / 100g à 20 ° C), la solubilité diminue avec la température (0,72 g / 100g à 100 ° C); insoluble dans acétone et éthanol.
Utilisations
Le médicament au lithium le plus courant est le carbonate de lithium, qui possède une action antimanie. Il est présumé que le lithium modifie le transport des ions sodium dans les neurones, influençant ainsi le contenu intercellulaire des catécholamines, normalisant l’état mental et ne provoquant pas de léthargie générale. Il est utilisé pour les états de manie d’origines diverses, les mesures préventives et pour traiter les psychoses affectives.
Utilisations
Le carbonate de lithium est utilisé comme composé pour produire du métalliclithium. Le carbonate de lithium est le résultat du traitement du spodumène minéral avec de l’acide sulfurique, puis de l’ajout de carbonate de calcium. Il est utilisé comme antidépresseur.
Utilise
Dans la production de glaçures sur céramique et porcelaine électrique.
Préparation
Le carbonate de lithium est préparé par précipitation du lithiumion par l’ion carbonate à partir d’une solution aqueuse. Encore un autre processus, qui est réalisé à une plus petiteéchelle, est la réaction d’une solution d’hydroxyde de lithium avec du dioxyde de carbone gazeux. Le carbonate de lithium précipite et est récupéré de la solution surnageante.
Définition
carbonate de lithium: Un solide blanc, Li2CO3; d.r. 2,11; p.f. 723 °C; se décompose au-dessus de 1310 °C. Il est produit commercialement en traitant le minerai avec de l’acide sulfurique à 250 ° C et en blanchissant le produit pour donner une solution de sulfate de lithium. Le carbonate est ensuite obtenu par précipitation avec une solution de carbonate de sodium.Le carbonate de lithium est utilisé dans la prévention et le traitement des désordres manicdepressived. Il est également utiliséindustriellement dans les glaçures en céramique.
Indications
Le lithium inhibe l’incorporation thyroïdienne d’I-dans la Tg, ainsi que la sécrétion d’hormones thyroïdiennes, mais il n’inhibe pas l’activité du symporteur Na +-I ou l’accumulation d’I- dans la thyroïde. Le lithium offre un avantage noparticulaire par rapport aux médicaments de la classe des thionamides, mais peut être utilisé pour le contrôle temporaire de la thyrotoxicose chez les patients allergiques aux thionamides et à l’iodure.
marque
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobide (JDS); Lithonate (Solvay Pharmaceuticals).
Description générale
Le carbonate de lithium (Eskalith, Lithane) et le citrate de lithium (Cibalith-S) sont les sels commercialisés aux États-Unis.
Profil de réactivité
Une base. Décomposé par les acides avec l’évolution du dioxyde de carbone. Le fluor brûle violemment au contact du carbonate de lithium.
Profil de sécurité
Données cancérogènes pour l’homme. Poison par voie intrapéritonéale et intraveineuse. Modérément toxique par ingestion et voies sous-cutanées. Effets systémiques humains par ingestion: psychose toxique, tremblements, modifications de l’apport hydrique, faiblesse musculaire, augmentation du volume urinaire, nausées ou vomissements, dermatite allergique. Effets sur la reproduction humaine par ingestion: effets sur le nouveau-né, y compris les changements du score d’Apgar et d’autres mesures ou effets néonatals. Effets tératogènes humains par ingestion: anomalies du développement du système cardiovasculaire, du système nerveux central, des systèmes musculo-squelettique et gastro-intestinal. Un tératogène expérimental. Effets expérimentaux sur la reproduction. Cancérogène expérimental produisant une leucémie et des tumeurs thyroïdiennes. Données sur les mutations humaines rapportées. Utilisé dans le traitement des psychoses maniaco-dépressives. Incompatible avec le fluor. Voir aussi COMPOSÉS DE LITHIUM.
Synthèse chimique
Le carbonate de lithium est synthétisé en faisant réagir des sels de lithium avec de la soude ou de la potasse, puis en purifiant le sel, qui n’est pas facilement soluble.
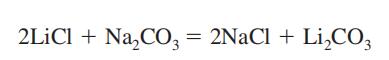
Exposition potentielle
Le carbonate de lithium est utilisé dans le traitement des psychoses maniaco-dépressives; pour fabriquer des céramiques et des glaçures de porcelaine; vernis, colorants, produits pharmaceutiques, revêtement d’électrodes de soudage à l’arc; alliages de batteries; nucléoniques, peintures luminescentes; vitrocéramiques; graisses lubrifiantes; dans la production d’aluminium
Expédition
UN2811 Solides toxiques, organiques, n.s.a., Classe de danger: 6.1; Étiquettes: 6.1 – Matériaux toxiques, Nom technique requis
Les méthodes de purification
Cristallisent l’eau. Sa solubilité diminue à mesure que la température augmente. La solubilité dans H2O est de 1,3% à ~ 10o, et de 0,7% à ~ 100o.
Incompatibilités
La solution aqueuse est une base forte.Réagit violemment avec les acides, le calcium en poudre et le fluor.Incompatible avec les oxydants (chlorates, nitrates, peroxydes, permanganates, perchlorates, chlore, brome, fluor, etc.); le contact peut provoquer des incendies ou des explosions. Gardez à l’écart des matériaux alcalins, des acides forts, du calcium en poudre, du fluor, de l’humidité. Corrode l’aluminium, le cuivre, le zinc.