- Lithiumcarbonat Chemische Eigenschaften, Verwendung, Produktion
- Beschreibung
- Chemische Eigenschaften
- Verwendungen
- Toxizität
- Herstellung
- Reaktionen
- Chemische Eigenschaften
- Physikalische Eigenschaften
- Verwendung
- Verwendung
- Verwendet
- Herstellung
- Definition
- Indikationen
- markenname
- Allgemeine Beschreibung
- Reaktivitätsprofil
- Sicherheitsprofil
- Chemische Synthese
- Mögliche Exposition
- Versand
- Reinigungsmethoden
- Inkompatibilitäten
Lithiumcarbonat Chemische Eigenschaften, Verwendung, Produktion
Beschreibung
Lithiumcarbonat (Molekülstruktur ist Li2CO3, englischer Name ist Lithiumcarbonat) als farbloser monokliner Kristall oder weißes Pulver. Die Dichte beträgt 2,11. Schmelzpunkt ist ℃ 618. Ohne Zerfließen ist es in der Luft stabil. Geringe Löslichkeit in Wasser, die Löslichkeit nimmt mit zunehmender Temperatur ab. Die Löslichkeit in kaltem Wasser ist größer als in heißem Wasser. Es ist löslich in verdünnter Säure, unlöslich in Alkohol und Aceton. Kohlendioxid wird in die wässrige Suspension von Lithiumcarbonat eingebracht, Lithiumcarbonat wird in Lithiumsäurecarbonat umgewandelt und gelöst. Wenn die Lösung von Lithiumsäurecarbonat erhitzt wird und dann Kohlendioxid freisetzt und Lithiumcarbonat ausfällt. Die Art des Lithiumcarbonats kann verwendet werden, um Verunreinigungen aus Lithiumcarbonat zu entfernen. Da Lithiumionen eine starke Polarisierbarkeit aufweisen und daher die thermische Stabilität von Lithiumcarbonat schlechter ist als bei anderen Alkalicarbonaten, zersetzt es sich beim Erhitzen über den Schmelzpunkt zu Kohlendioxid und Lithiumoxid.
Chemische Eigenschaften
Lithiumcarbonat ist ein weißer monokliner kristalliner Feststoff. Typischerweise für Carbonate reagiert Lithiumcarbonat mit Säuren, die stärker sind als Kohlendioxid oder Kohlensäure, um das Lithiumsalz der Säure und des Kohlendioxids zu erhalten. Die Reaktionen können in einer Lösung, als wässrige Aufschlämmung oder, weniger effektiv, mit festem Lithiumcarbonat durchgeführt werden.
Lithiumcarbonat weist eine geringe Wasserlöslichkeit für ein Alkalimetallcarbonat auf. Die Löslichkeit nimmt mit steigender Temperatur ab. Es ist nicht hygroskopisch und im Allgemeinen stabil, wenn es der Atmosphäre ausgesetzt wird. Tatsächlich ist es die normale Endverbindung, die auftritt, wenn viele basische Lithiumverbindungen der Atmosphäre ausgesetzt sind. Lithiumcarbonat kann durch Umwandlung in Hydrogencarbonat in Wasser gelöst werden. Die Freisetzung von Kohlendioxid durch Erhitzen der Lösung von Lithiumhydrogencarbonat bewirkt eine Umfällung des Lithiumcarbonats.
Verwendungen
Die Lithiumcarbonatindustrie ist eine globale Monopolindustrie, die derzeitige Produktionskapazität konzentriert sich hauptsächlich auf drei ausländische Hersteller von SQM, FMC, Chemetall und so weiter.
Industrielles Lithiumcarbonat wird bei der Herstellung anderer Lithiumsalze wie Lithiumchlorid und Lithiumbromid usw. verwendet. Es wirkt auch als Lithiumoxidmaterialien in Emaille, Glas, Keramik und Porzellanemail und wird der Elektrolysezelle zur Elektrolyse von Aluminium zugesetzt, um die Stromausbeute zu erhöhen und den Innenwiderstand der Zelle und die Badtemperatur zu verringern. In der Medizin wird es hauptsächlich zur Behandlung von Manie eingesetzt, kann ihre emotionalen Störungen bei Schizophrenie verbessern. Es hat die Wirkung, periphere Leukozyten zu erhöhen; kann für synthetischen Kautschuk, Farbstoffe, Halbleiter und militärische Verteidigungsindustrie und so weiter verwendet werden; für die Herstellung von Lithiumtantalat, Lithiumniobat und anderen Einkristallen mit akustischer Qualität, monokristalliner optischer Qualität usw.; zur Herstellung des Einkristalls mit akustischer Qualität.
Lithiumcarbonat in Batteriequalität wird hauptsächlich zur Herstellung von Lithiumkobaltoxid, Lithiummanganoxid, ternären Materialien, Lithiumeisenphosphat und anderen Lithiumionenbatteriekathodenmaterialien verwendet. in einem Matrixmodifikator verwendet; als neuroprotektive Wirkung von Lithiumcarbonat bei amyotropher Lateralsklerose.
Toxizität
Lithiumcarbonat hat eine signifikante stimulierende Wirkung, die den Magen-Darm-Trakt, die Niere und das zentrale Nervensystem schädigt. Toxizitätsreihenfolge von Lithiumverbindungen ist Li <LiCl <Li2CO3, maximal zulässige Konzentration: Lithiumkondensation und Fragmentierungsaerosol betrugen 0,05 mg/ m3 und 0,5 mg/m3.
Tragen Sie bei der Arbeit Gummihandschuhe und Schutzmasken, um die Atmungsorgane vor Staub zu schützen.
Herstellung
Lithiumcarbonat wird als Zwischenprodukt bei der Gewinnung von Lithiummetall aus seinem Erz Spodumen erhalten (siehe Lithium). Es wird hergestellt, indem eine heiße und konzentrierte Lösung von Natriumcarbonat mit Lithiumchlorid- oder Sulfatlösung gemischt wird.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
Reaktionen
Lithiumcarbonat reagiert mit verdünnten Säuren und setzt Kohlendioxid frei:
Li2CO3+ HCl →LiCl + CO2+ H2O
Thermische Zersetzung ergibt Lithiumoxid und Kohlendioxid:
Li2CO3 → Li2O + CO2
Reaktion mit Kalk erzeugt Lithiumhydroxid:
Li2CO3 + Ca(OH) 2 →2LiOH + CaCO3
Das Carbonat reagiert mit geschmolzenem Aluminiumfluorid, das in Lithiumfluorid umgewandelt wird:
3Li2CO3+ 2AlF3 → 6lif + 3CO2+ Al2O3
Es verbindet sich mit Kohlendioxid in wässriger Aufschlämmung und bildet lösliches Bicarbonat, das sich beim Erhitzen zu Carbonat zersetzt:
Li2CO3+ CO2+ H2O →2LiHCO3
Das Bicarbonat kann nicht in fester Form abgetrennt werden. Es existiert nur in Lösung, wenn sich Carbonat in mit CO gesättigtem Wasser auflöst2unter Druck.
Chemische Eigenschaften
Lithiumcarbonat ist ein weißes hygroskopisches Pulver.
Physikalische Eigenschaften
Weiße monokline Kristalle; Brechungsindex 1,428; Dichte 2,11 g / cm3; schmilzt bei 723 ° C; zersetzt sich bei 1.310 ° C; geringe Löslichkeit in Wasser (1,54 g / 100 g) bei 0 ° C; 1,32 g // 100 g bei 20 ° C), Löslichkeitsabnahme mit der Temperatur (0,72 g / 100 g bei 100 ° C); unlöslich in Aceton und Ethanol.
Verwendung
Das häufigste Lithiumarzneimittel ist Lithiumcarbonat, das Antimania-Wirkung besitzt. Es wird vermutet, dass Lithium den Transport von Natriumionen in Neuronen verändert und so den interzellulären Inhalt von Katecholaminen beeinflusst, den mentalen Zustand normalisiert und keine allgemeine Lethargie verursacht. Es wird für Maniezustände verschiedener Herkunft, vorbeugende Maßnahmen und zur Behandlung von affektiven Psychosen verwendet.
Verwendung
Lithiumcarbonat wird als Verbindung zur Herstellung von Metalliclithium verwendet. Lithiumcarbonat ist das Ergebnis der Behandlung des Minerals Spodumen mit Schwefelsäure und anschließender Zugabe von Calciumcarbonat. Es wird als Antidepressivum verwendet.
Verwendet
Bei der Herstellung von Glasuren auf Keramik und Elektroporzellan.
Herstellung
Lithiumcarbonat wird durch Fällung von Lithiumion durch Carbonationen aus einer wässrigen Lösung hergestellt. Noch ein anderer Prozess, der auf einem kleineren durchgeführt wirdmaßstab, ist die Reaktion einer Lösung von Lithiumhydroxid mit Kohlendioxidgas. Lithiumcarbonat fällt aus und wird aus der überstehenden Lösung gewonnen.
Definition
Lithiumcarbonat: Ein weißer Feststoff, Li2CO3; r.d. 2.11; smp. 723°C; zersetzt sichüber 1310°C. Es wird kommerziell hergestellt, indem das Erz mit Schwefelsäure bei 250 ° C behandelt und das Produkt zu einer Lösung von Lithiumsulfat ausgelaugt wird. Das Carbonat wird dann durch Fällung mit Natriumcarbonatlösung erhalten.Lithiumcarbonat wird in der Prävention und Behandlung von manischen depressiven Störungen verwendet. Es wird auch verwendetindustriell in keramischen Glasuren.
Indikationen
Lithium hemmt den thyreoidalen Einbau von I- in Tg sowie die Sekretion von Schilddrüsenhormonen, hemmt jedoch nicht die Aktivität des Na + -I- Symporters oder die Akkumulation von I- in der Schilddrüse. Lithium bietet keinen besonderen Vorteil gegenüber Arzneimitteln der Thionamid-Klasse, kann jedoch zur vorübergehenden Kontrolle der Thyreotoxikose bei Patienten eingesetzt werden, die sowohl gegen Thionamid als auch gegen Iodid allergisch sind.
markenname
Eskalith (GlaxoSmithKline); Lithan (Bayer); Lithobid(JDS); Lithonat (Solvay Pharmaceuticals).
Allgemeine Beschreibung
Lithiumcarbonat (Eskalith, Lithan) und Lithiumcitrat (Cibalith-S) sind die in den Vereinigten Staaten kommerziell erhältlichen Salze.
Reaktivitätsprofil
Eine Base. Zersetzt durch Säuren unter Entwicklung von Kohlendioxid. Fluor brennt bei Kontakt mit Lithiumcarbonat heftig.
Sicherheitsprofil
Humankarzinogene Daten. Gift durch intraperitoneale und intravenöse Wege. Mäßig toxisch durch Verschlucken und subkutan. Systemische Wirkungen beim Menschen durch Einnahme: toxische Psychose, Zittern, Veränderungen der Flüssigkeitsaufnahme, Muskelschwäche, erhöhtes Urinvolumen, Übelkeit oder Erbrechen, allergische Dermatitis. Auswirkungen auf das Neugeborene, einschließlich Änderungen des Apgar-Scores und anderer neonataler Maßnahmen oder Auswirkungen. Menschliche teratogene Wirkungen durch Einnahme: Entwicklungsstörungen des Herz-Kreislauf-Systems, des Zentralnervensystems, des Bewegungsapparates und des Magen-Darm-Systems. Ein experimentelles Teratogen. Experimentelle reproduktive Effekte. Experimentelle Karzinogen produzierende Leukämie und Schilddrüsentumoren. Menschliche Mutationsdaten berichtet. Verwendet in der Behandlung von manisch-depressiven Psychosen. Unverträglich mit Fluor. Siehe auch LITHIUMVERBINDUNGEN.
Chemische Synthese
Lithiumcarbonat wird durch Reaktion von Lithiumsalzen mit Soda synthetisiertoder Kali, gefolgt von Reinigung des Salzes, das nicht leicht löslich ist .
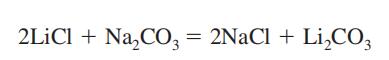
Mögliche Exposition
Lithiumcarbonat wird bei der Behandlung von manisch-depressiven Psychosen verwendet; zur Herstellung von Keramik und Porzellanglasur; Lacke, Farbstoffe, Pharmazeutika, Beschichtung von ARC-Schweißelektroden; Batterielegierungen; Nukleonik, Lumineszenzfarben; Glaskeramik; Schmierfette; in der Aluminiumproduktion
Versand
UN2811 Toxische Feststoffe, organisch, n.a.g., Gefahrenklasse : 6.1; Etiketten: 6.1-Giftige Materialien, technischer Name erforderlich
Reinigungsmethoden
Kristallisieren Sie es aus Wasser. Seine Löslichkeit nimmt mit zunehmender Temperatur ab. Die Löslichkeit in H2O beträgt 1,3% bei ~ 10o und 0,7% bei ~ 100o.
Inkompatibilitäten
Die wässrige Lösung ist eine starke Base.Reagiert heftig mit Säuren, Calciumpulver und Fluor.Unverträglich mit Oxidationsmitteln (Chlorate, Nitrate, Peroxide, Permanganate, Perchlorate, Chlor, Brom, Fluor usw.); Berührung kann Brände oder Explosionen verursachen. Keep awayfrom alkalische Materialien, starke Säuren, pulverisiertes Kalzium, Fluor, Feuchtigkeit. Korrodiert Aluminium, Kupfer, Zink.