- Lithiumcarbonaat chemische eigenschappen,Gebruik, productie
- omschrijving
- chemische eigenschappen
- gebruikt
- toxiciteit
- preparaat
- reacties
- chemische eigenschappen
- fysische eigenschappen
- gebruikt
- gebruik
- gebruikt
- preparaat
- definitie
- indicaties
- merknaam
- algemene beschrijving
- Reactiviteitsprofiel
- veiligheidsprofiel
- Chemische Synthese
- Potentiële Blootstelling
- Scheepvaart
- Zuivering Methodes
- onverenigbaarheden
Lithiumcarbonaat chemische eigenschappen,Gebruik, productie
omschrijving
Lithiumcarbonaat (moleculaire structuur is Li2CO3, Engelse naam is lithiumcarbonaat) als een kleurloos monoclinisch kristal of wit poeder. Dichtheid is 2,11. Smeltpunt is 618 ℃. Zonder deliquescence is het stabiel in de lucht. Lage oplosbaarheid in water, de oplosbaarheid neemt af met toenemende temperatuur. Oplosbaarheid in koud water is groter dan warm water. Het is oplosbaar in verdund zuur, onoplosbaar in alcohol en aceton. Koolstofdioxide wordt in de waterige suspensie van lithiumcarbonaat gebracht, lithiumcarbonaat wordt omgezet in lithiumzuurcarbonaat en opgelost. Als de oplossing van lithiumzuurcarbonaat wordt verhit en vervolgens kooldioxide vrijmaakt en lithiumcarbonaat neerslaat. De aard van het lithiumcarbonaat mag worden gebruikt om onzuiverheden uit lithiumcarbonaat te verwijderen. Aangezien Lithiumion een sterke polariseerbaarheid heeft, is de thermische stabiliteit van lithiumcarbonaat slechter dan ander alkalimetaalcarbonaat, wanneer het tot boven het smeltpunt wordt verwarmd, zal het ontbinden om koolstofdioxide en lithiumoxide te produceren.
chemische eigenschappen
Lithiumcarbonaat is een witte monoclinische kristallijne vaste stof. Typisch voor carbonaten reageert lithiumcarbonaat met zuren die sterker zijn dan kooldioxide of koolzuur om het lithiumzout van het zuur en kooldioxide op te leveren. De reacties kunnen worden uitgevoerd in een oplossing, als een waterige drijfmest, of, minder effectief, met vast lithiumcarbonaat.Lithiumcarbonaat vertoont een lage oplosbaarheid in water voor een alkalimetaalcarbonaat. De oplosbaarheid neemt af met toenemende temperatuur. Het is niet hygroscopisch en is over het algemeen stabiel bij blootstelling aan de atmosfeer. In feite, is het de normale eindsamenstelling die wordt ontmoet wanneer vele fundamentele lithiumsamenstellingen aan de atmosfeer worden blootgesteld. Lithiumcarbonaat kan in water worden opgelost door omzetting in waterstofcarbonaat. Het vrijgeven van kooldioxide door het verwarmen van de oplossing van lithiumwaterstofcarbonaat veroorzaakt reprecipitatie van het lithiumcarbonaat.
gebruikt
de lithiumcarbonaatindustrie is een wereldwijde industrie met een hoog monopolie, de huidige productiecapaciteit is voornamelijk geconcentreerd in drie buitenlandse fabrikanten van SQM, FMC, Chemetall, enzovoort.Industrieel lithiumcarbonaat wordt gebruikt bij de vervaardiging van andere lithiumzouten, zoals lithiumchloride en lithiumbromide, enzovoort. Het werkt ook als lithiumoxide materialen in email, glas, aardewerk en porselein email, en het wordt ook toegevoegd aan de elektrolytische cel voor elektrolyse van aluminium om de huidige efficiëntie te verhogen en de interne weerstand van de cel en de badtemperatuur te verminderen. In de geneeskunde wordt het voornamelijk gebruikt voor de behandeling van manie, kan hun emotionele stoornissen voor schizofrenie verbeteren. Het heeft het effect van het opheffen van perifere leukocyten; kan etc. voor synthetisch rubber, kleurstoffen, halfgeleider en militaire defensie-industrie worden gebruikt; voor de productie van lithiumtantalaat, lithium-niobaat en andere akoestische kwaliteit single crystal, optische kwaliteit monokristallijne enz.; voor de bereiding van de akoestische kwaliteit single crystal. lithiumcarbonaat van batterijkwaliteit wordt voornamelijk gebruikt voor de bereiding van lithiumkobaltoxide, lithiummangaanoxide, ternaire materialen, lithiumijzer fosfaat en andere lithiumionbatterijkathodematerialen; gebruikt in een matrixmodificator; als een Europees beschermend effect van lithiumcarbonaat bij amyotrofe laterale sclerose.
toxiciteit
Lithiumcarbonaat heeft een significant stimulerend effect, in de eerste plaats heeft het schade aan het maagdarmkanaal, de nieren en het centrale zenuwstelsel. Toxiciteitsvolgorde van lithiumverbindingen is Li <LiCl <Li2CO3, maximaal toelaatbare concentratie: Lithiumcondensatie en fragmentatie aerosol waren 0,05 mg/m3 en 0,5 mg/m3.draag rubberen handschoenen en beschermende maskers tijdens het werken, om de ademhalingsorganen te beschermen tegen stof.
preparaat
Lithiumcarbonaat wordt verkregen als tussenproduct bij de terugwinning van lithiummetaal uit zijn erts, spodumeen (zie Lithium). Het wordt bereid door het mengen van een hete en geconcentreerde oplossing van natriumcarbonaat met lithiumchloride of sulfaatoplossing.
Li2SO4 + Na2CO3→Li2CO3 + Na2SO4
reacties
Lithiumcarbonaat reageert met verdunde zuren, waaruit kooldioxide vrijkomt:
Li2CO3+ HCl →LiCl + CO2 + H2O
thermische ontleding levert lithiumoxide en koolstofdioxide op:
Li2CO3 → Li2O + CO2
reactie met kalk produceert lithiumhydroxide:
Li2CO3 + Ca (OH) 2→2LiOH + CaCO3
het carbonaat reageert met gesmolten aluminiumfluoride dat wordt omgezet in lithiumfluoride:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
Het combineert met kooldioxide in waterige drijfmest die oplosbaar bicarbonaat vormt, dat bij verhitting ontbindt tot carbonaat:
Li2CO3+ CO2+ H2O →2LiHCO3
het bicarbonaat kan niet in vaste vorm worden gescheiden. Het bestaat alleen in oplossing wanneer carbonaat oplost in water verzadigd met CO2 onder druk.
chemische eigenschappen
Lithiumcarbonaat is een wit hygroscopisch poeder.
fysische eigenschappen
witte monoclinische kristallen; brekingsindex 1,428; dichtheid 2,11 g / cm3; smelt bij 723°C; ontleedt bij 1,310°c; lage oplosbaarheid in water (1,54 g/100g) bij 0°C; 1,32 g//100g bij 20°C); Oplosbaarheid daalt bij temperatuur (0,72 g/100g bij 100°C); onoplosbaar in aceton en ethanol.
gebruikt
het meest voorkomende lithiumgeneesmiddel is lithiumcarbonaat, dat een antimaniewerking heeft. Er wordt aangenomen dat lithium het transport van natriumionen in neuronen verandert, waardoor de intercellulaire inhoud van catecholamines wordt beïnvloed, waardoor de mentale toestand wordt genormaliseerd en geen algemene lethargie wordt veroorzaakt. Het wordt gebruikt voor manie voorwaarden van verschillende oorsprong, preventieve maatregelen, en voor de behandeling van affectieve psychoses.
gebruik
Lithiumcarbonaat wordt gebruikt als verbinding voor de productie van metalliclithium. Lithiumcarbonaat is het resultaat van de behandeling van het mineraal spodumeen met zwavelzuur en vervolgens toe te voegen calciumcarbonaat. Het wordt gebruikt als antidepressivum.
gebruikt
bij de productie van glazuren op keramisch en elektrisch porselein.
preparaat
Lithiumcarbonaat wordt bereid door precipitatie van lithiumion door carbonaation uit een waterige oplossing. Nog een ander proces, dat op kleine schaal wordt uitgevoerd, is de reactie van een oplossing van lithiumhydroxide met kooldioxidegas. Lithiumcarbonaat precipiteert en wordt teruggewonnen uit de supernatans oplossing.
definitie
lithiumcarbonaat: een witte vaste stof, Li2CO3; r. d. 2,11; m. p. 723°C; ontleding boven 1310 ° C. Het wordt commercieel geproduceerd door het erts te behandelen met zwavelzuur bij 250°C en het product te verlaten om een oplossing van lithiumsulfaat te verkrijgen. Het carbonaatwordt vervolgens verkregen door precipitatiemet natriumcarbonaatoplossing.Lithiumcarbonaat wordt gebruikt bij de preventie en behandeling van manicdepressieve stoornissen. Het wordt ook industrieel gebruikt in keramische glazuren.
indicaties
Lithium remt de thyreoïdale inbouw van I – in Tg, evenals de secretie van schildklierhormonen, maar het remt niet de activiteit van de na+-I – symporter of de aanmaak van I – in de schildklier. Lithium biedt geen particulair voordeel ten opzichte van geneesmiddelen van de thionamideklassbut kan worden gebruikt voor tijdelijke controle van thyrotoxicose bij patiënten die allergisch zijn voor zowel thionamide als jodide.
merknaam
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
algemene beschrijving
Lithiumcarbonaat(Eskalith, Lithaan) en lithiumcitraat (Cibalith-S) zijn de zouten die in de Verenigde Staten in de handel verkrijgbaar zijn.
Reactiviteitsprofiel
een base. Ontleed door zuren met de evolutie van kooldioxide. Fluor brandt fel bij contact met Lithiumcarbonaat.
veiligheidsprofiel
carcinogene gegevens bij de mens. GIF via intraperitoneale en intraveneuze routes. Matig toxisch door inslikken en subcutaan. Systemische effecten bij de mens door inname: toxische psychose, tremoren, veranderingen in vochtinname, spierzwakte, verhoogd urinevolume, misselijkheid of braken, allergische dermatitis. Effecten op de voortplanting bij de mens door inname: effecten op pasgeborenen, waaronder veranderingen in de Apgar-score en andere neonatale maatregelen of effecten. Bij de mens teratogene effecten door ingestie: ontwikkelingsstoornissen afwijkingen van het cardiovasculaire systeem, centrale zenuwstelsel, musculoskeletale en gastro-intestinale systemen. Een experimenteel teratogeen. Experimentele reproductieve effecten. Experimentele carcinogeen die leukemie en schildkliertumoren veroorzaken. Mutatiegegevens bij de mens gerapporteerd. Gebruikt bij de behandeling van manisch-depressieve psychoses. Onverenigbaar met Fluor. Zie ook LITHIUMVERBINDINGEN.
Chemische Synthese
Lithiumcarbonaat wordt gesynthetiseerd door lithiumzouten te laten reageren met sodaor potas, gevolgd door zuivering van het zout, dat niet gemakkelijk oplosbaar is .
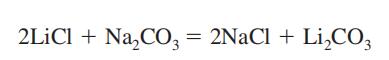
Potentiële Blootstelling
Lithium carbonaat wordt gebruikt in treatmentof manisch-depressieve psychosen; te maken keramiek en porselein glazuur; vernis, kleurstoffen, geneesmiddelen, coating ofarc-lassen van elektroden; batterij legeringen; nucleonics, lichtgevende verf; glas, keramiek, smeervetten; in aluminium productie
Scheepvaart
UN2811 Giftige vaste stoffen, organische, n.o.s., HazardClass: 6.1; Labels: 6.1-Giftige materialen, TechnicalName Vereist
Zuivering Methodes
Kristalliseren van water. De oplosbaarheid neemt af naarmate de temperatuur stijgt. De oplosbaarheid in H2O is 1,3% bij ~10o en 0,7% bij ~100o.
onverenigbaarheden
de waterige oplossing is een sterke base.Reageert heftig met zuren, calciumpoeder en fluor.Onverenigbaar met oxidatiemiddelen (chloraten, nitraten,peroxiden, permanganaten, perchloraten, chloor, broom,fluor, enz.); contact kan branden of explosies veroorzaken. Houd afstandvan alkalische materialen, Sterke zuren, calciumpoeder, fluor, vocht. Corrodeert aluminium, koper, zink.