- litiumkarbonaatti kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
- kuvaus
- kemialliset ominaisuudet
- käyttää
- toksisuus
- valmiste
- reaktiot
- kemialliset ominaisuudet
- fysikaaliset ominaisuudet
- käyttää
- käyttää
- käyttää
- valmiste
- määritelmä
- käyttöaiheet
- tuotenimi
- yleinen kuvaus
- Reaktiivisuusprofiili
- turvallisuusprofiili
- kemiallinen synteesi
- potentiaalinen altistuminen
- laivaliikenne
- puhdistusmenetelmät
- yhteensopimattomuudet
litiumkarbonaatti kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
kuvaus
litiumkarbonaatti (molekyylirakenne on Li2CO3, englanninkielinen nimi on litiumkarbonaatti) värittömänä monokliinisenä kiteenä tai valkoisena jauheena. Tiheys on 2,11. Sulamispiste on 618 ℃. Ilman delikesenssiä se on stabiili ilmassa. Alhainen liukoisuus veteen, liukoisuus vähenee lämpötilan noustessa. Liukoisuus kylmään veteen on suurempi kuin kuumaan veteen. Se liukenee laimeaan happoon, liukenematon alkoholiin ja asetoniin. Hiilidioksidi johdetaan litiumkarbonaatin vesisuspensioon, litiumkarbonaatti muutetaan litiumhappokarbonaatiksi ja liuotetaan. Kuumennettaessa litiumhappokarbonaattiliuosta se vapauttaa hiilidioksidia ja saostaa litiumkarbonaattia. Litiumkarbonaatin luonnetta voidaan käyttää epäpuhtauksien poistamiseen litiumkarbonaatista. Koska litiumionilla on voimakas polarisoituvuus, jolloin litiumkarbonaatin lämpöstabiilisuus on huonompi kuin muilla alkalimetallikarbonaateilla, kuumennettaessa sulamispisteen yläpuolelle se hajoaa muodostaen hiilidioksidia ja litiumoksidia.
kemialliset ominaisuudet
litiumkarbonaatti on valkoinen monokliininen kiteinen kiinteä aine. Tyypillisesti karbonaateille litiumkarbonaatti reagoi hiilidioksidia tai hiilihappoa vahvempien happojen kanssa muodostaen hapon ja hiilidioksidin litiumsuolan. Reaktiot voidaan suorittaa liuoksessa, vesiliuoksena tai heikommin kiinteällä litiumkarbonaatilla.
litiumkarbonaatin vesiliukoisuus alkalimetallikarbonaatiksi on alhainen. Liukoisuus vähenee lämpötilan noustessa. Se ei ole hygroskooppista ja on yleensä stabiili altistuessaan ilmakehälle. Itse asiassa se on normaali loppuyhdiste, johon törmätään, kun monet emäksiset litiumyhdisteet altistuvat ilmakehälle. Litiumkarbonaattia voidaan liuottaa veteen muuntamalla se vetykarbonaatiksi. Hiilidioksidin vapauttaminen kuumentamalla litiumvetykarbonaattiliuosta aiheuttaa litiumkarbonaatin uudelleenreksitaation.
käyttää
litiumkarbonaattiteollisuus on maailmanlaajuinen korkean monopolin teollisuus, nykyinen tuotantokapasiteetti on keskittynyt pääasiassa kolmelle ulkomaiselle valmistajalle neliömetriä, FMC: tä, Kemetallia ja niin edelleen.
teollista litiumkarbonaattia käytetään muiden litiumsuolojen, kuten litiumkloridin ja litiumbromidin valmistukseen ja niin edelleen. Se toimii myös litiumoksidimateriaaleina emalissa, lasissa, keramiikassa ja posliinissa, ja sitä lisätään myös elektrolyyttikennoon alumiinin elektrolyysiä varten nykyisen tehokkuuden lisäämiseksi ja solun sisäisen vastuksen ja kylvyn lämpötilan vähentämiseksi. Lääketieteessä sitä käytetään pääasiassa manian hoitoon, voi parantaa skitsofrenian emotionaalisia häiriöitä. Sillä on perifeeristen leukosyyttien kohottamisen vaikutus; sitä voidaan käyttää synteettiseen kumiin, väriaineisiin, puolijohteisiin ja sotilaalliseen puolustusteollisuuteen ja niin edelleen; litium-tantalaatin, litium-niobaatin ja muiden akustisten yksikiteiden, optisen luokan yksikiteisten jne. tuotantoon; akustisen luokan yksikiteen valmistukseen.
Akkukelpoista litiumkarbonaattia käytetään pääasiassa litiumkobolttioksidin, litiummangaanioksidin, ternaaristen materiaalien, litiumrautafosfaatin ja muiden litiumioniakkujen katodimateriaalien valmistukseen; käytetään matriisimodulaattorissa; litiumkarbonaatin Euroopan suojaavana vaikutuksena amyotrofisessa lateraaliskleroosissa.
toksisuus
litiumkarbonaatilla on merkittävä stimuloiva vaikutus, ensinnäkin sillä on vaurioita ruoansulatuskanavassa, munuaisissa ja keskushermostossa. Litiumyhdisteiden myrkyllisyysjärjestys on Li <LiCl <Li2CO3, suurin sallittu pitoisuus: litiumin tiivistyminen ja pirstoutuminen aerosoli olivat 0,05 mg/m3 ja 0,5 mg/m3.
käytä kumikäsineitä ja suojanaamareita työskennellessään hengityselinten suojaamiseksi pölyltä.
valmiste
litiumkarbonaattia saadaan välituotteena litiummetallin talteenotossa sen malmista, spodumeenista (Katso litium). Sitä valmistetaan sekoittamalla kuumaa ja väkevää natriumkarbonaattiliuosta litiumkloridi-tai sulfaattiliuokseen.
Li2SO4 + Na2CO3→Li2CO3 + Na2SO4
reaktiot
litiumkarbonaatti reagoi laimeiden happojen kanssa vapauttaen hiilidioksidia:
Li2CO3 + HCl →LiCl + CO2 + H2O
terminen hajoaminen tuottaa litiumoksidia ja hiilidioksidia:
Li2CO3 → Li2O + CO2
reaktio kalkin kanssa tuottaa litiumhydroksidia:
Li2CO3+ Ca(OH)2→2lioh + CaCO3
karbonaatti reagoi sulan alumiinifluoridin kanssa muuttuen litiumfluoridiksi:
3li2co3+ 2alf3 → 6lif + 3CO2+ Al2O3
se yhdistyy hiilidioksidin kanssa vesiliuoksessa muodostaen liukoisen bikarbonaatin, joka hajoaa karbonaatiksi kuumennettaessa:
Li2CO3+ CO2+ H2O →2lihco3
bikarbonaattia ei voida erottaa kiinteässä muodossa. Sitä esiintyy liuoksessa vain, kun karbonaatti liukenee CO2-paineen kyllästämään veteen.
kemialliset ominaisuudet
litiumkarbonaatti on valkoinen hygroskooppinen jauhe.
fysikaaliset ominaisuudet
valkoiset monokliiniset kiteet; taitekerroin 1.428; tiheys 2.11 g/cm3; sulaa 723°C: ssa; hajoaa 1.310°C: ssa; alhainen liukoisuus veteen (1.54 g/100 g) 0°C: ssa; 1.32 g//100 g 20°C: ssa), liukoisuuden väheneminen lämpötilassa (0.72 g/100 g 100°C: ssa); liukenematon asetoniin ja etanolia.
käyttää
yleisin litiumlääke on litiumkarbonaatti, jolla on antimania-vaikutusta. Oletetaan, että litium muuttaa natriumionien kuljetusta neuroneissa, mikä vaikuttaa katekoliamiinien solujen väliseen sisältöön, normalisoi henkistä tilaa eikä aiheuta yleistä uneliaisuutta. Sitä käytetään mania olosuhteissa eri alkuperää, ennaltaehkäiseviä toimenpiteitä, ja hoitoon affektiivinen psykooseja.
käyttää
litiumkarbonaattia yhdisteenä metalliklitiumin valmistamiseen. Litiumkarbonaattia saadaan käsittelemällä spodumeenia rikkihapolla ja lisäämällä siihen sitten kalsiumkarbonaattia. Sitä käytetään masennuslääkkeenä.
käyttää
lasitteiden valmistuksessa keraamiseen ja sähköiseen posliiniin.
valmiste
litiumkarbonaattia valmistetaan saostamalla litiumionia karbonaatti-ionilla vesiliuoksesta. Vielä toinen prosessi, joka suoritetaan pienelläsuurella, on litiumhydroksidiliuoksen reaktio hiilidioksidikaasun kanssa. Litiumkarbonaatti saostuu ja otetaan talteen supernatanttiliuoksesta.
määritelmä
litiumkarbonaatti: valkoinen kiinteä aine,Li2CO3; r.d. 2.11; m.p. 723°C; hajoaa 1310°C: ssa. Se valmistetaan kaupallisesti käsittelemällä Malmi rikkihapolla 250°C: n lämpötilassa ja liuottamalla tuote litiumsulfaattiliuokseksi. Karbonaatti saadaan saostamalla natriumkarbonaattiliuoksella.Litiumkarbonaattia käytetään ehkäisyssä ja hoidossa hoidettujenhoito. Sitä käytetään myösteollisestikeraamisissa lasitteissa.
käyttöaiheet
litium estää I -: n tyreoidista inkorporoitumista Triglyseridiin sekä kilpirauhashormonien eritystä, mutta se ei estä Na+-I – symporterin toimintaa eikä I -: n kumuloitumista kilpirauhasessa. Litium tarjoaa nopean etulyöntiaseman tionamidiluokkaan kuuluviin lääkkeisiin verrattuna, mutta sitä voidaan käyttää tyrotoksikosiinipotilaiden tilapäiseen kontrollointiin, jotka ovat allergisia sekä tionamideille että jodidille.
tuotenimi
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
yleinen kuvaus
litiumkarbonaatti (Eskaliitti, Litaani) ja litiumsitraatti(Cibalith-S) ovat yhdistetyissä valtioissa kaupallisesti saatavilla olevia suoloja.
Reaktiivisuusprofiili
A emäs. Hapot hajoavat hiilidioksidin evoluution myötä. Fluori palaa kiivaasti joutuessaan kosketuksiin litiumkarbonaatin kanssa.
turvallisuusprofiili
tiedot ihmisen karsinogeenisuudesta. Myrkkyä vatsaonteloon ja laskimoon. Kohtalaisen Myrkyllistä nieltynä ja ihonalaisena reittinä. Ihmisen systeemiset vaikutukset nieltynä: toksinen psykoosi, vapina, muutokset nesteen saannissa, lihasheikkous, lisääntynyt virtsamäärä, pahoinvointi tai oksentelu, allerginen dermatiitti. Ihmisen lisääntymiseen liittyvät vaikutukset nieltynä: vaikutukset vastasyntyneisiin, mukaan lukien Apgar-pisteytyksen muutokset ja muut vastasyntyneen toimenpiteet tai vaikutukset. Ihmisen teratogeeniset vaikutukset nieltynä: sydän-ja verisuonijärjestelmän, keskushermoston, tuki-ja liikuntaelinten sekä ruoansulatuskanavan kehityshäiriöt. Kokeellinen teratogeeni. Kokeelliset lisääntymisvaikutukset. Kokeellinen karsinogeeni, joka tuottaa leukemiaa ja kilpirauhaskasvaimia. Ihmisen mutaatiotiedot raportoitu. Käytetään maanis-depressiivisten psykoosien hoidossa. Yhteensopimaton fluorin kanssa. Katso myös LITIUMYHDISTEET.
kemiallinen synteesi
litiumkarbonaattia syntetisoidaan reagoimalla litiumsuoloja sodaor-potaskan kanssa, minkä jälkeen suola puhdistetaan, mikä ei liukene helposti .
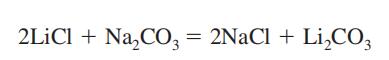
potentiaalinen altistuminen
litiumkarbonaattia käytetään maanis-depressiivisten psykoosien hoidossa; keramiikan ja posliinilasitteiden valmistuksessa; lakat, väriaineet, lääkkeet, hitsauselektrodien päällystäminen; akkuseokset; nukleoniikka, luminesenssimaalit; lasikeramiikka; voitelurasvat; alumiinituotannossa
laivaliikenne
Un2811 toksiset kiinteät aineet, orgaaniset, ei sovelleta, hazardclass: 6.1; labels: 6.1-myrkylliset materiaalit, tekninen nimi vaaditaan
puhdistusmenetelmät
kiteytetään vedestä. Sen Liukoisuus vähenee lämpötilan noustessa. Liukoisuus H2O: hon on 1,3% ~10o: ssa ja 0,7% ~100o: ssa.
yhteensopimattomuudet
vesiliuos on vahva emäs.Reagoi kiivaasti happojen, jauhemaisen kalsiumin ja fluorin kanssa.Yhteensopimaton hapettimien kanssa (kloraatit, nitraatit, peroksidit,permanganaatit, perkloraatit, kloori, bromi, fluori jne.); kosketus voi aiheuttaa tulipaloja tai räjähdyksiä. Pidä away emäksisistä materiaaleista, vahvoista hapoista, kalsiumjauheesta, fluorista, kosteudesta. Syövyttää alumiinia, kuparia, sinkkiä.