- Carbonato di litio Proprietà chimiche, usi, produzione
- Descrizione
- Proprietà chimiche
- Usi
- Tossicità
- Preparazione
- Reazioni
- Proprietà chimiche
- proprietà Fisiche
- Usi
- Usi
- Utilizza
- Preparazione
- Definizione
- Indicazioni
- marca commerciale
- Descrizione generale
- Profilo di reattività
- Profilo di sicurezza
- Sintesi chimica
- il Potenziale di Esposizione
- Spedizione
- Metodi di Purificazione
- Incompatibilità
Carbonato di litio Proprietà chimiche, usi, produzione
Descrizione
carbonato di litio (la struttura molecolare è Li2CO3, il nome inglese è carbonato di litio) come cristallo monoclino incolore o polvere bianca. La densità è 2.11. Punto di fusione è 618 ℃. Senza deliquescenza, è stabile nell’aria. Bassa solubilità in acqua, la solubilità diminuisce con l’aumentare della temperatura. La solubilità in acqua fredda è maggiore dell’acqua calda. È solubile in acido diluito, insolubile in alcool e acetone. L’anidride carbonica viene introdotta nella sospensione acquosa di carbonato di litio, il carbonato di litio viene convertito in carbonato di acido litio e disciolto. Se la soluzione di carbonato di acido di litio viene riscaldata e quindi rilascia anidride carbonica e precipita carbonato di litio. La natura del carbonato di litio può essere utilizzata per rimuovere le impurità dal carbonato di litio. Poiché lo lithium di litio ha una forte polarizzabilità, quindi la stabilità termica del carbonato di litio è peggiore di altri carbonati di metalli alcalini, quando riscaldato al di sopra del punto di fusione, si decompone per produrre anidride carbonica e ossido di litio.
Proprietà chimiche
Il carbonato di litio è un solido cristallino monoclino bianco. Tipicamente per i carbonati, il carbonato di litio reagisce con acidi più forti dell’anidride carbonica o dell’acido carbonico per produrre il sale di litio dell’acido e dell’anidride carbonica. Le reazioni possono essere effettuate in una soluzione, come una sospensione acquosa, o, meno efficacemente, con carbonato di litio solido.
Il carbonato di litio presenta una bassa solubilità in acqua per un carbonato di metalli alcalini. La solubilità diminuisce con l’aumentare della temperatura. Non è igroscopico ed è generalmente stabile quando esposto all’atmosfera. In realtà, è il composto finale normale incontrato quando molti composti di litio di base sono esposti all’atmosfera. Il carbonato di litio può essere disciolto in acqua mediante conversione nell’idrogeno carbonato. Rilasciando anidride carbonica riscaldando la soluzione di idrogeno carbonato di litio provoca la riprecipitazione del carbonato di litio.
Usi
L’industria del carbonato di litio è un’industria monopolistica globale, l’attuale capacità produttiva è concentrata principalmente in tre produttori stranieri di mq, FMC, Chemetall e così via.
Carbonato di litio industriale è utilizzato nella produzione di altri sali di litio, come cloruro di litio e bromuro di litio e così via. Agisce anche come materiali di ossido di litio in smalto, vetro, ceramica e smalto porcellanato, e viene anche aggiunto alla cella elettrolitica per l’elettrolisi dell’alluminio per aumentare l’efficienza corrente e ridurre la resistenza interna della cella e la temperatura del bagno. In medicina, è utilizzato principalmente per il trattamento della mania, può migliorare i loro disturbi emotivi per la schizofrenia. Ha l’effetto di elevare i leucociti periferici; può essere utilizzato per gomma sintetica, coloranti, semiconduttori e industria della difesa militare e così via; per la produzione di tantalato di litio, niobato di litio e altri cristalli singoli di grado acustico, monocristallino di grado ottico ecc; per la preparazione del cristallo singolo di grado acustico.
Il carbonato di litio del grado della batteria pricipalmente è usato per la preparazione dell’ossido del cobalto del litio, dell’ossido del manganese del litio, dei materiali ternari, del fosfato del ferro del litio e di altri materiali del catodo della batteria dello lithium del litio; utilizzato in un modificatore della matrice; come effetto aneuroprotective di carbonato di litio nella sclerosi laterale amiotrofica.
Tossicità
Il carbonato di litio ha un significativo effetto stimolante, in primo luogo ha danni al tratto gastrointestinale, ai reni e al sistema nervoso centrale. L’ordine di tossicità dei composti del litio è Li <LiCl <Li2CO3, concentrazione massima consentita: condensazione al litio e aerosol a frammentazione erano 0,05 mg / m3 e 0,5 mg / m3.
Indossare guanti di gomma e maschere protettive durante il lavoro, al fine di proteggere gli organi respiratori dalla polvere.
Preparazione
Il carbonato di litio è ottenuto come prodotto intermedio nel recupero del litio metallico dal suo minerale, lo spodumene (vedi Litio). Viene preparato mescolando una soluzione calda e concentrata di carbonato di sodio con soluzione di cloruro di litio o solfato.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
Reazioni
Il carbonato di litio reagisce con acidi diluiti, liberando anidride carbonica:
Li2CO3 + HCl →LiCl + CO2 + H2O
La decomposizione termica produce ossido di litio e anidride carbonica:
Li2CO3 → Li2O + CO2
La reazione con calce:
Li2CO3 + Ca (OH)2→2LiOH + CaCO3
Il carbonato reagisce con fluoruro di alluminio fuso convertendo in fluoruro di litio:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
Si combina con anidride carbonica in liquami acquosi formando bicarbonato solubile, che si decompone in carbonato al riscaldamento:
Li2CO3+ CO2+ H2O →2LiHCO3
Il Esiste solo in soluzione quando il carbonato si dissolve in acqua satura di CO2sotto pressione.
Proprietà chimiche
Il carbonato di litio è una polvere igroscopica bianca.
proprietà Fisiche
Bianco monoclino cristalli; indice di rifrazione 1.428; densità 2.11 g/cm3; fonde a 723°C; decompone a 1,310°C; bassa solubilità in acqua (1,54 g/100g) a 0°C; 1.32 g//100g a 20°C) solubilità diminuisce con la temperatura (0.72 g/100g a 100°C); insolubile in acetone ed etanolo.
Usi
Il farmaco al litio più comune è il carbonato di litio, che possiede un’azione antimania. Si presume che il litio alteri il trasporto di ioni sodio nei neuroni, influenzando così il contenuto intercellulare delle catecolamine, normalizzando lo stato mentale e non causando letargia generale. Viene utilizzato per le condizioni di mania di varia origine, misure preventive e per il trattamento di psicosi affettive.
Usi
Il carbonato di litio è usato come composto per la produzione di metalliclitio. Il carbonato di litio è il risultato del trattamento dello spodumene minerale con sulfuricacid e quindi l’aggiunta di carbonato di calcio. È usato come antidepressivo.
Utilizza
Nella produzione di smalti su ceramica e porcellana elettrica.
Preparazione
Il carbonato di litio viene preparato dalla precipitazione di litio da parte di carbonate carbonato da una soluzione acquosa. Ancora un altro processo, che viene eseguito su un più piccoloscala, è la reazione di una soluzione di idrossido di litio con gas di anidride carbonica. Lithiumcarbonate precipita e viene recuperato dalla soluzione surnatante.
Definizione
carbonato di litio: un solido bianco,Li2CO3; r. d. 2.11; m. p. 723°C; decomposesabove 1310°C. Viene prodotto commercialmente trattando il minerale con acido solforico a 250°C e rilasciando il prodotto per dare una soluzione di solfato di litio. Il carbonato è quindi ottenuto per precipitazione con soluzione di carbonato di sodio.Il carbonato di litio è usato nella prevenzione e nel trattamento di disturbi maniacali. È anche usatoindustrialmente in smalti ceramici.
Indicazioni
Il litio inibisce l’incorporazione tiroidea di I-in Tg, così come la secrezione di ormoni tiroidei, ma non inibisce l’attività del Na+-I – symporter o l’accumulo di I – all’interno della tiroide. Il litio offre il vantaggio noparticolare sopra le droghe del classbut di tionamide può essere impiegato per controllo temporaneo dei pazienti di thyrotoxicosisin che sono allergici a entrambi i tionamidesand ioduro.
marca commerciale
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
Descrizione generale
Lithiumcarbonate (Eskalith, Lithane) e citrato di litio(Cibalith-S) sono i sali disponibili in commercio negli Stati Uniti.
Profilo di reattività
Una base. Decomposto dagli acidi con l’evoluzione dell’anidride carbonica. Il fluoro brucia ferocemente a contatto con il carbonato di litio.
Profilo di sicurezza
Dati cancerogeni nell’uomo. Veleno per via intraperitoneale e endovenosa. Moderatamente tossico per ingestione e per via sottocutanea. Effetti sistemici umani per ingestione: psicosi tossica, tremori, cambiamenti nell’assunzione di liquidi, debolezza muscolare, aumento del volume delle urine, nausea o vomito, dermatite allergica. Effetti riproduttivi umani per ingestione: effetti sul neonato, incluse le variazioni del punteggio di Apgar e altre misure o effetti neonatali. Effetti teratogeni umani per ingestione: anomalie dello sviluppo del sistema cardiovascolare, del sistema nervoso centrale, dei sistemi muscolo-scheletrici e gastrointestinali. Un teratogeno sperimentale. Effetti riproduttivi sperimentali. Cancerogeno sperimentale producendo leucemia e tumori della tiroide. Dati sulla mutazione umana riportati. Utilizzato nel trattamento delle psicosi maniaco-depressive. Incompatibile con il fluoro. Vedi anche COMPOSTI DI LITIO.
Sintesi chimica
Il carbonato di litio viene sintetizzato facendo reagire i sali di litio con soda o potassa, seguita dalla purificazione del sale, che non è facilmente solubile .
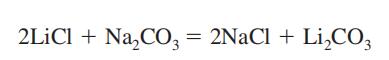
il Potenziale di Esposizione
carbonato di Litio è usato in treatmentof maniaco-depressive, psicosi; per la ceramica e porcellana smalto; vernici, coloranti, prodotti farmaceutici, rivestimento ofarc-elettrodi per saldatura; batteria leghe; nucleonics luminescente, vernici, vetro ceramica grassi lubrificanti; nella produzione di alluminio
Spedizione
UN2811 Tossici, solidi, organici, n.o.s., HazardClass: 6.1; Etichette: 6.1-materiali tossici, TechnicalName Richiesto
Metodi di Purificazione
Cristallizzare dall’acqua. La sua solubilità diminuisce all’aumentare della temperatura. La solubilità in H2O è 1,3% a ~10o e 0,7% a ~100o.
Incompatibilità
La soluzione acquosa è una base forte.Reagisce violentemente con acidi, calcio in polvere e fluoro.Incompatibile con ossidanti (clorati, nitrati,perossidi, permanganati, perclorati, cloro, bromo,fluoro, ecc.); il contatto può causare incendi o esplosioni. Tenere lontano da materiali alcalini, acidi forti,calcio in polvere, fluoro, umidità. Corrode alluminio, rame, zinco.