- lítium-karbonát kémiai tulajdonságok, felhasználás, gyártás
- leírás
- kémiai tulajdonságok
- Uses
- toxicitás
- a
- reakciók
- kémiai tulajdonságok
- Fizikai tulajdonságok
- a
- meghatározás
- javallatok
- márkanév
- Általános leírás
- reaktivitási profil
- biztonságossági profil
- a Kémiai Szintézis
- Potenciális Kitettség
- Szállítás
- a Tisztítási Módszereket
- Inkompatibilitások
lítium-karbonát kémiai tulajdonságok, felhasználás, gyártás
leírás
lítium-karbonát (molekuláris szerkezete Li2CO3, angol neve lítium-karbonát) színtelen Monoklin kristály vagy fehér por. A sűrűség 2,11. Olvadáspont 618 ℃. Delikvencia nélkül stabil a levegőben. Alacsony vízben való oldhatóság, az oldhatóság a hőmérséklet növekedésével csökken. A hideg vízben való oldhatóság nagyobb, mint a forró víz. Híg savban oldódik, alkoholban és acetonban nem oldódik. A szén-dioxidot a lítium-karbonát vizes szuszpenziójába vezetik be, a lítium-karbonátot lítium-sav-karbonáttá alakítják és feloldják. Ha a lítium-sav-karbonát oldatát felmelegítik, akkor szén-dioxidot bocsát ki, és lítium-karbonátot csap ki. A lítium-karbonát jellege felhasználható a szennyeződések eltávolítására a lítium-karbonátból. Mivel a lítium-ion erős polarizálhatósággal rendelkezik, így a lítium-karbonát termikus stabilitása rosszabb, mint más alkálifém-karbonáté, az olvadáspont fölé hevítve bomlik, hogy szén-dioxidot és lítium-oxidot termeljen.
kémiai tulajdonságok
A lítium-karbonát fehér Monoklin kristályos szilárd anyag. Jellemzően a karbonátok esetében a lítium-karbonát a szén-dioxidnál vagy a szénsavnál erősebb savakkal reagál, így a sav és a szén-dioxid lítiumsója keletkezik. A reakciókat oldatban, vizes szuszpenzióban, vagy kevésbé hatékonyan, szilárd lítium-karbonáttal lehet végrehajtani.
A lítium-karbonát alkálifém-karbonát esetében alacsony vízoldékonyságot mutat. Az oldhatóság a hőmérséklet növekedésével csökken. Nem higroszkópos, általában stabil, ha a légkörnek van kitéve. Valójában ez a normális végvegyület, amely akkor fordul elő, amikor sok alapvető lítium-vegyület ki van téve a légkörnek. A lítium-karbonát vízben oldható a hidrogén-karbonát átalakításával. A szén-dioxid felszabadítása a lítium-hidrogén-karbonát oldatának melegítésével a lítium-karbonát újracsomagolását okozza.
Uses
A lítium-karbonát ipar globális monopóliumú iparág,a jelenlegi termelési kapacitás elsősorban a SQM, az FMC, a Chemetall stb.
Az ipari lítium-karbonátot más lítium-sók, például lítium-klorid, lítium-bromid stb. gyártásához használják. Ez is működik, mint a lítium-oxid anyagok zománc, üveg, kerámia, porcelán zománc, és azt is hozzá, hogy az elektrolízis az alumínium, hogy növelje a jelenlegi hatékonyság, valamint csökkenti a belső ellenállás A sejt, valamint a fürdő hőmérséklete. Az orvostudományban elsősorban a mánia kezelésére használják, javíthatja a skizofrénia érzelmi rendellenességeit. Ez az a hatása, felemelő perifériás leukociták; lehet használni a szintetikus gumi, festékek, félvezető, katonai védelmi ipar, stb; lítium-tantalát, lítium-niobát és más akusztikus minőségű egykristály, optikai minőségű monokristályos stb. gyártásához; akusztikus minőségű egykristály készítéséhez.
akkumulátor minőségű lítium-karbonát elsősorban előállítására használt lítium-kobalt-oxid, lítium-mangán-oxid, háromkomponensű anyagok, lítium-vas-foszfát és egyéb lítium-ion akkumulátor katód anyagok; használt mátrix módosító; mint aneuroprotektív hatása lítium-karbonát amiotrófiás laterális szklerózis.
toxicitás
A lítium-karbonát jelentős stimuláló hatást fejt ki, először is károsítja a gyomor-bél traktust, a vesét és a központi idegrendszert. A lítiumvegyületek toxicitási sorrendje Li <LiCl <Li2CO3, maximális megengedett koncentráció: a lítium kondenzációs és fragmentációs aeroszol 0,05 mg/m3 és 0,5 mg/m3 volt.
munka közben viseljen gumikesztyűt és védőmaszkot a légzőszervek por elleni védelme érdekében.
a
lítium-karbonát előállítását közbenső termékként állítják elő a lítium ércéből, a spoduménből történő visszanyerése során(lásd lítium). Nátrium-karbonát forró és koncentrált oldatának lítium-klorid vagy szulfát oldattal történő összekeverésével állítják elő.
Li2SO4 + Na2CO3→Li2CO3 + Na2SO4
reakciók
A lítium-karbonát híg savakkal reagál, szén-dioxidot szabadít fel:
Li2CO3 + HCl →LiCl+ CO2 + H2O
a termikus dekompozíció lítium-oxidot és szén-dioxidot eredményez:
Li2CO3 → Li2O + CO2
A mészreakció lítium-hidroxidot eredményez:
Li2CO3+ Ca(OH)2→2LiOH + CaCO3
A-karbonát reagál olvadt alumínium-fluorid konvertáló, hogy a lítium-fluorid:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
egyesíti a szén-dioxid vizes hígtrágya alkotó oldható hidrogén-karbonát, amely lebomlik karbonát esetén fűtés:
Li2CO3+ CO2+ H2O →2LiHCO3
A hidrogén-karbonát nem lehet elválasztani szilárd formában. Csak oldatban létezik, amikor a karbonát feloldódik a CO2-vel telített vízben. nyomás alatt.
kémiai tulajdonságok
A lítium-karbonát fehér higroszkópos por.
Fizikai tulajdonságok
Fehér monoclinic kristályok; törésmutató 1.428; sűrűség 2.11 g/cm3; olvad a 723°C; bomlik, 1,310°C; alacsony oldhatóság vízben (a 1,54 g/100g) 0°C; 1.32 g//100g 20°C-on), oldhatóság csökken a hőmérséklet (0.72 g/100g 100°C); acetonban oldhatatlan etanol.
A leggyakoribb lítium gyógyszer a lítium-karbonát, amely antimániás hatással rendelkezik. Azt feltételezik, hogy a lítium megváltoztatja a nátrium-ionok neuronokban történő szállítását, ezáltal befolyásolja a katekolaminok intercelluláris tartalmát, normalizálja a mentális állapotot, és nem okozáltalános letargiát. Különböző eredetű mániás állapotokra, megelőző intézkedésekre,valamint affektív pszichózisok kezelésére használják.
A lítium-karbonátot metalliclithium előállítására szolgáló vegyületként használják. A lítium-karbonát az ásványi spodumén szulfursavval történő kezelésének eredménye, majd kalcium-karbonát hozzáadásával. Antidepresszánsként használják.
kerámia és elektromos porcelán mázak gyártásánál használatos.
a
lítium-karbonátot a lithiumion vizes oldatból származó karbonátion kicsapásával állítjuk elő. Még egy másik folyamat, amelyet kicsiben végzünkskála, a lítium-hidroxid oldatának reakciója szén-dioxid gázzal. A lithiumkarbonát kicsapódik és a felülúszó oldatból nyerhető ki.
meghatározás
lítium-karbonát: fehér szilárd anyag,Li2CO3; R. d. 2.11; m. p. 723°C; bomlik1310°C felett. Az ércet 250°C-on kénsavval kezeljük, és a terméket lítium-szulfát oldására használjuk. A karbonátot ezután kicsapással állítjuk elő nátrium-karbonát oldattal.A lítium-karbonátot a megelőzésben használjákés a mániás kezelésdepressivedisorders. Azt is használjákipari kerámia mázakban.
javallatok
A lítium gátolja az I – TG tiroid beépülését, valamint a pajzsmirigyhormonok szekrécióját, de nem gátolja a Na+-I – symporter aktivitását vagy az i – a pajzsmirigyben történő felhalmozódását. Lítium kínál nopartikuláris előnyt gyógyszerek a thionamid classbut lehet alkalmazni ideiglenes ellenőrzése tireotoxikozizin betegek, akik allergiásak mindkét thionamidés jodid.
márkanév
Eskalith (GlaxoSmithKline); Lithane(Bayer); Lithobid (jds); Lithonate (Solvay Pharmaceuticals).
Általános leírás
A Lithiumcarbonát (Eskalith, Lithane) és a lítium-citrát(Cibalith-S) a kereskedelemben kapható sók.
reaktivitási profil
a bázis. Savakkal bomlik a szén-dioxid fejlődésével. A fluor hevesen ég, amikor lítium-karbonáttal érintkezik.
biztonságossági profil
humán karcinogén adatok. Intraperitoneális és intravénás úton történő mérgezés. Lenyeléssel és szubkután módon mérsékelten mérgező. Emberi szisztémás hatások lenyeléssel: toxikus pszichózis, remegés, folyadékbevitel változása, izomgyengeség, megnövekedett vizeletmennyiség, hányinger vagy hányás, allergiás dermatitis. Emberi reprodukciós hatások lenyeléssel: újszülöttekre gyakorolt hatások, beleértve az Apgar pontszámváltozásokat és egyéb újszülöttkori intézkedéseket vagy hatásokat. Humán teratogén hatások lenyeléssel: a cardiovascularis rendszer, a központi idegrendszer, a vázizom-és a gyomor-bélrendszer fejlődési rendellenességei. Kísérleti teratogén. Kísérleti reprodukciós hatások. Kísérleti karcinogén leukémiát és pajzsmirigydaganatot termel. Humán mutációs adatok. Mániás-depressziós pszichózisok kezelésére használják. Nem kompatibilis a fluorral. Lásd még lítium vegyületek.
a Kémiai Szintézis
Lítium-karbonát szintetizálódik reagál lítium-sók a sodaor hamuzsír, amelyet tisztítás a só, amely nem könnyen oldódik .
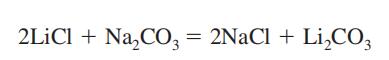
Potenciális Kitettség
Lítium-karbonát használt treatmentof mániás-depresszív pszichózis; hogy, kerámia, illetve porcelán máz; lakkok, festékek, gyógyszerek, bevonat ofarc-hegesztő elektródák; akkumulátor ötvözetek; nucleonics, világító festékek; üveg kerámia; kenőanyagok, zsírok; az alumínium gyártás
Szállítás
UN2811 Mérgező, szilárd, szerves, n.o.s., HazardClass: 6.1; Címkék: 6.1 Mérgező anyagok, TechnicalName Szükséges
a Tisztítási Módszereket
Crystallise a víz. Oldhatósága a hőmérséklet emelkedésével csökken. A H2O oldhatósága 1,3% ~10o-nál, 0,7% ~100o-nál.
Inkompatibilitások
a vizes oldat erős bázis.Savakkal, porított kalciummal és fluorral Hevesen reagál.Nem kompatibilis az oxidálószerekkel (klorátok, nitrátok,peroxidok, permanganátok, Perklorátok, klór, bróm,fluor stb.); az érintkezés tüzet vagy robbanást okozhat. Tartsa távol lúgos anyagok, Erős savak, porított kalcium, fluor, nedvesség. Korrodálja alumínium, réz, cink.