- Propiedades químicas del carbonato de litio,Usos,Producción
- Descripción
- Propiedades químicas
- Utiliza
- Toxicidad
- Preparado
- Propiedades químicas
- Propiedades físicas
- Usos
- Usos
- Utiliza
- Preparación
- Definición
- Indicaciones
- marca
- Descripción general
- Perfil de reactividad
- Perfil de seguridad
- Síntesis química
- Exposición potencial
- Envío
- Métodos de purificación
- Incompatibilidades
Propiedades químicas del carbonato de litio,Usos,Producción
Descripción
Carbonato de litio (la estructura molecular es Li2CO3, el nombre en inglés es carbonato de litio) como cristal monoclínico incoloro o polvo blanco. La densidad es de 2.11. El punto de fusión es de 618 ℃. Sin delicuescencia, es estable en el aire. Baja solubilidad en agua, la solubilidad disminuye con el aumento de la temperatura. La solubilidad en agua fría es mayor que en agua caliente. Es soluble en ácido diluido, insoluble en alcohol y acetona. El dióxido de carbono se introduce en la suspensión acuosa de carbonato de litio, el carbonato de litio se convierte en carbonato de ácido de litio y se disuelve. Si la solución de carbonato de ácido de litio se calienta y luego libera dióxido de carbono y precipita carbonato de litio. La naturaleza del carbonato de litio puede utilizarse para eliminar las impurezas del carbonato de litio. Dado que la ion de litio tiene una fuerte polarizabilidad, la estabilidad térmica del carbonato de litio es peor que la de otros carbonatos de metales alcalinos, cuando se calienta por encima del punto de fusión, se descompondrá para producir dióxido de carbono y óxido de litio.
Propiedades químicas
El carbonato de litio es un sólido cristalino monoclínico blanco. Típicamente para los carbonatos, el carbonato de litio reacciona con ácidos más fuertes que el dióxido de carbono o el ácido carbónico para producir la sal de litio del ácido y el dióxido de carbono. Las reacciones pueden llevarse a cabo en una solución, como una suspensión acuosa o, con menor eficacia, con carbonato de litio sólido.El carbonato de litio exhibe una baja solubilidad en agua para un carbonato de metal alcalino. La solubilidad disminuye con el aumento de la temperatura. No es higroscópico y generalmente es estable cuando se expone a la atmósfera. De hecho, es el compuesto final normal que se encuentra cuando muchos compuestos básicos de litio se exponen a la atmósfera. El carbonato de litio se puede disolver en agua mediante conversión a hidrogenocarbonato. La liberación de dióxido de carbono al calentar la solución de hidrogenocarbonato de litio causa la reprecipitación del carbonato de litio.
Utiliza
La industria del carbonato de litio es una industria mundial de alto monopolio, la capacidad de producción actual se concentra principalmente en tres fabricantes extranjeros de SQM, FMC, Chemetall, etc.El carbonato de litio industrial se utiliza en la fabricación de otras sales de litio, como cloruro de litio y bromuro de litio, etc. También actúa como materiales de óxido de litio en esmalte, vidrio, cerámica y esmalte de porcelana, y también se agrega a la celda electrolítica para la electrólisis del aluminio para aumentar la eficiencia actual y reducir la resistencia interna de la celda y la temperatura del baño. En medicina, se utiliza principalmente para el tratamiento de la manía, puede mejorar sus trastornos emocionales para la esquizofrenia. Tiene el efecto de elevar los leucocitos periféricos; se puede usar para caucho sintético, colorantes, semiconductores e industria de defensa militar, etc.; para la producción de tantalato de litio, niobato de litio y otros monocristalinos de grado acústico, monocristalinos de grado óptico, etc.; para la preparación del monocristalino de grado acústico. El carbonato de litio de grado de batería se utiliza principalmente para la preparación de óxido de cobalto de litio, óxido de manganeso de litio, materiales ternarios, fosfato de hierro de litio y otros materiales de cátodo de batería de iones de litio; se utiliza en un modificador de matriz; como efecto protector europeo del carbonato de litio en la esclerosis lateral amiotrófica.
Toxicidad
El carbonato de litio tiene un efecto estimulante significativo, en primer lugar tiene daños en el tracto gastrointestinal, los riñones y el sistema nervioso central. El orden de toxicidad de los compuestos de litio es Li <LiCl <Li2CO3, concentración máxima permitida: El aerosol de condensación y fragmentación de litio fue de 0,05 mg/m3 y 0,5 mg / m3.Use guantes de goma y máscaras protectoras cuando trabaje, para proteger los órganos respiratorios del polvo.
Preparado
El carbonato de litio se obtiene como producto intermedio en la recuperación de metal de litio de su mena, espodumeno (véase Litio). Se prepara mezclando una solución caliente y concentrada de carbonato de sodio con cloruro de litio o solución de sulfato.
Reacciones de Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
El carbonato de litio reacciona con ácidos diluidos, liberando dióxido de carbono:
Li2CO3 + HCl →LiCl + CO2 + H2O
La descomposición térmica produce óxido de litio y dióxido de carbono:
Li2CO3 → Li2O + CO2
La reacción con cal produce hidróxido de litio:
Li2CO3+ Ca(OH)2→2LiOH + CaCO3
El carbonato reacciona con el fluoruro de aluminio fundido convirtiéndose en fluoruro de litio:
3Li2CO3+ 2AlF3 → 6LiF + 3CO2+ Al2O3
Se combina con dióxido de carbono en suspensión acuosa formando bicarbonato soluble, que se descompone en carbonato al calentarse:
Li2CO3+ CO2+ H2O →2LiHCO3
El bicarbonato no se puede separar en forma sólida. Solo existe en solución cuando el carbonato se disuelve en agua saturada con CO2 bajo presión.
Propiedades químicas
El carbonato de litio es un polvo higroscópico blanco.
Propiedades físicas
Cristales monoclínicos blancos; índice de refracción 1.428; densidad 2.11 g/cm3; se derrite a 723°C; se descompone a 1.310°C; baja solubilidad en agua (1.54 g/100 g) a 0°C; 1.32 g//100 g a 20°C), disminución de la solubilidad con la temperatura (0.72 g/100 g a 100°C); insoluble en acetona y etanol.
Usos
El fármaco de litio más común es el carbonato de litio, que posee acción antimania. Se presume que el litio altera el transporte de iones de sodio en las neuronas, influyendo así en el contenido intercelular de las catecolaminas, normalizando el estado mental y no causando letargo general. Se utiliza para condiciones de manía de diversos orígenes, medidas preventivas y para tratar psicosis afectivas.
Usos
El carbonato de litio se utiliza como compuesto para producir litio metálico. El carbonato de litio es el resultado de tratar el mineral espodumeno con sulfúrico ácido y luego agregar carbonato de calcio. Se usa como antidepresivo.
Utiliza
En la producción de esmaltes sobre cerámica y porcelana eléctrica.
Preparación
El carbonato de litio se prepara mediante la precipitación de litio por iones de carbonato a partir de una solución acuosa. Otro proceso, que se lleva a cabo a pequeña escala, es la reacción de una solución de hidróxido de litio con gas dióxido de carbono. El carbonato de litio precipita y se recupera de la solución sobrenadante.
Definición
carbonato de litio: sólido blanco, Li2CO3; r.d. 2,11; p. m. 723 ° C; se descompone a partir de 1310°C. Se produce comercialmente mediante el tratamiento del mineral con ácido sulfúrico a 250°C y la extracción del producto para obtener una solución de sulfato de litio. El carbono se obtiene por precipitación con solución de carbonato de sodio.El carbonato de litio se utiliza en la prevención y el tratamiento de trastornos de la manicura. También se utiliza industrialmente en esmaltes cerámicos.
Indicaciones
El litio inhibe la incorporación tiroidea de I – en Tg, así como la secreción de hormonas tiroideas, pero no inhibe la actividad del simportador Na+-I o la acumulación de I – en la tiroides. El litio ofrece una ventaja noparticular sobre los medicamentos de la clase de la tionamida, pero se puede emplear para el control temporal de los pacientes con tirotoxicosisina que son alérgicos tanto a la tionamida como al yoduro.
marca
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
Descripción general
El carbonato de litio (Eskalith, Lithane) y el citrato de litio(Cibalith-S) son las sales disponibles comercialmente en los Estados Unidos.
Perfil de reactividad
A base. Descompuesto por ácidos con la evolución del dióxido de carbono. El flúor se quema ferozmente al contacto con carbonato de litio.
Perfil de seguridad
Datos sobre carcinógenos humanos. Veneno por vía intraperitoneal e intravenosa. Moderadamente tóxico por ingestión y vía subcutánea. Efectos sistémicos humanos por ingestión: psicosis tóxica, temblores, cambios en la ingesta de líquidos, debilidad muscular, aumento del volumen de orina, náuseas o vómitos, dermatitis alérgica. Efectos reproductivos humanos por ingestión: efectos en el recién nacido, incluidos los cambios en la puntuación de Apgar y otras medidas o efectos neonatales. Efectos teratogénicos humanos por ingestión: anomalías del desarrollo del sistema cardiovascular, el sistema nervioso central, los sistemas musculoesquelético y gastrointestinal. Un teratógeno experimental. Efectos reproductivos experimentales. Carcinógeno experimental que produce leucemia y tumores tiroideos. Datos de mutaciones humanas reportados. Utilizado en el tratamiento de psicosis maníaco-depresivas. Incompatible con flúor. Véase también COMPUESTOS DE LITIO.
Síntesis química
El carbonato de litio se sintetiza mediante la reacción de sales de litio con potasa sodaor, seguida de la purificación de la sal, que no es fácilmente soluble .
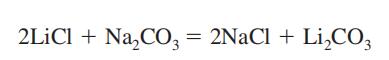
Exposición potencial
El carbonato de litio se utiliza en el tratamiento de psicosis maníaco-depresivas; para fabricar esmaltes de cerámica y porcelana; barnices, tintes, productos farmacéuticos, recubrimientos de electrodos de soldadura arc; aleaciones de baterías; nucleónicos, pinturas luminiscentes; vitrocerámicas; grasas lubricantes; en la producción de aluminio
Envío
UN2811 Sólidos tóxicos, orgánicos, n.e.p., Clase peligrosa: 6.1; Etiquetas: 6.1-Materiales venenosos, Nombre técnico Requerido
Métodos de purificación
Cristalizarlo a partir del agua. Su solubilidad disminuye a medida que aumenta la temperatura. La solubilidad en H2O es del 1,3% a ~10o y del 0,7% a ~100o.
Incompatibilidades
La solución acuosa es una base fuerte.Reacciona violentamente con ácidos, calcio en polvo y flúor.Incompatible con oxidantes (cloratos, nitratos, peróxidos, permanganatos, percloratos, cloro, bromo, flúor, etc.); el contacto puede causar incendios o explosiones. Manténgase alejado de materiales alcalinos, ácidos fuertes, calcio en polvo, flúor, humedad. Corroe aluminio, cobre, zinc.