- węglan litu właściwości chemiczne, zastosowania, produkcja
- opis
- właściwości chemiczne
- wykorzystuje
- toksyczność
- preparat
- reakcje
- właściwości chemiczne
- właściwości fizyczne
- używa
- zastosowania
- wykorzystuje
- przygotowanie
- definicja
- wskazania
- Nazwa handlowa
- Opis ogólny
- profil reaktywności
- profil bezpieczeństwa
- Synteza chemiczna
- potencjalna ekspozycja
- Wysyłka
- metody oczyszczania
- niezgodności
węglan litu właściwości chemiczne, zastosowania, produkcja
opis
węglan litu (struktura molekularna to Li2CO3, angielska nazwa to węglan litu) jako bezbarwny kryształ monokliniczny lub biały proszek. Gęstość wynosi 2,11. Temperatura topnienia wynosi 618 ℃. Bez rozpływu jest stabilny w powietrzu. Niska rozpuszczalność w wodzie, Rozpuszczalność maleje wraz ze wzrostem temperatury. Rozpuszczalność w zimnej wodzie jest większa niż w gorącej wodzie. Jest rozpuszczalny w rozcieńczonym kwasie, nierozpuszczalny w alkoholu i acetonie. Dwutlenek węgla wprowadza się do wodnej zawiesiny węglanu litu, węglan litu przekształca się w węglan kwasu litu i rozpuszcza. Jeśli roztwór węglanu kwasu litu jest podgrzewany, a następnie uwalnia dwutlenek węgla i wytrąca węglan litu. Charakter węglanu litu można wykorzystać do usuwania zanieczyszczeń z węglanu litu. Ponieważ jon litu ma silną polaryzację, dlatego stabilność termiczna węglanu litu jest gorsza niż w przypadku innych węglanów metali alkalicznych, po podgrzaniu do temperatury powyżej temperatury topnienia ulegnie rozkładowi w celu wytworzenia dwutlenku węgla i tlenku litu.
właściwości chemiczne
węglan litu jest białym monoklinicznym krystalicznym ciałem stałym. Zazwyczaj w przypadku węglanów węglan litu reaguje z kwasami silniejszymi niż dwutlenek węgla lub kwas węglowy, uzyskując sól litu kwasu i dwutlenku węgla. Reakcje można prowadzić w roztworze, w postaci wodnej zawiesiny lub, mniej skutecznie, w postaci stałego węglanu litu.
węglan litu wykazuje niską rozpuszczalność w wodzie w przypadku węglanu metalu alkalicznego. Rozpuszczalność maleje wraz ze wzrostem temperatury. Nie jest higroskopijny i jest na ogół stabilny pod wpływem atmosfery. W rzeczywistości jest to normalny związek końcowy spotykany, gdy wiele podstawowych związków litu jest wystawionych na działanie atmosfery. Węglan litu może być rozpuszczony w wodzie poprzez przekształcenie w wodorowęglan. Uwalnianie dwutlenku węgla przez podgrzanie roztworu wodorowęglanu litu powoduje ponowne wystąpienie węglanu litu.
wykorzystuje
przemysł węglanu litu jest światowym przemysłem o wysokim monopolu, obecna zdolność produkcyjna koncentruje się głównie w trzech zagranicznych producentach m2, FMC, Chemetall i tak dalej.
Przemysłowy węglan litu jest stosowany do produkcji innych soli litu, takich jak chlorek litu i bromek litu i tak dalej. Działa również jako materiały tlenku litu w emalii, szkle, ceramice i emalii porcelanowej, a także jest dodawany do ogniwa elektrolitycznego do elektrolizy aluminium, aby zwiększyć wydajność prądu i zmniejszyć wewnętrzny opór ogniwa i temperaturę kąpieli. W medycynie stosuje się go głównie w leczeniu manii, może poprawić zaburzenia emocjonalne schizofrenii. Ma wpływ na podniesienie leukocytów obwodowych; może być stosowany do kauczuku syntetycznego, barwników, półprzewodników i wojskowego przemysłu obronnego i tak dalej; do produkcji tantalanu litu, niobanu litu i innego pojedynczego kryształu klasy akustycznej, monokrystalicznej klasy optycznej itp.; do przygotowania pojedynczego kryształu klasy akustycznej.
węglan litu klasy baterii stosuje się głównie do wytwarzania tlenku kobaltu litu, tlenku manganu litu, materiałów trójskładnikowych, fosforanu litu i innych materiałów katodowych baterii litowo-jonowych; stosowany w modyfikatorze matrycowym; jako aneuroprotekcyjne działanie węglanu litu w stwardnieniu zanikowym bocznym.
toksyczność
węglan litu ma znaczący efekt stymulujący, po pierwsze ma uszkodzenie przewodu pokarmowego, nerek i ośrodkowego układu nerwowego. Kolejność toksyczności związków litu wynosi Li <LiCl <Li2CO3, maksymalne dopuszczalne stężenie: aerozol kondensacyjny i fragmentacyjny litu wynosił 0,05 mg/m3 i 0,5 mg/m3.
podczas pracy należy nosić gumowe rękawice i maski ochronne, aby chronić narządy oddechowe przed kurzem.
preparat
węglan litu otrzymuje się jako produkt pośredni w odzyskiwaniu metalu litu z jego rudy, spodumenu (Patrz lit). Wytwarza się go przez zmieszanie gorącego i stężonego roztworu węglanu sodu z roztworem chlorku litu lub siarczanu.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4
reakcje
węglan litu reaguje z rozcieńczonymi kwasami, uwalniając dwutlenek węgla:
Li2CO3+ HCl →LiCl + CO2 + H2O
rozkład termiczny daje tlenek litu i dwutlenek węgla:
Li2CO3 → Li2O + CO2
reakcja z wapnem wytwarza wodorotlenek litu:
Li2CO3+ Ca(OH)2→2lioh + CaCO3
węglan reaguje ze stopionym fluorkiem glinu przekształcającym się w fluorek litu:
3li2co3 + 2ALF3 → 6lif+ 3co2+ Al2O3
łączy się z dwutlenkiem węgla w wodnej zawiesinie, tworząc rozpuszczalny wodorowęglan, który rozkłada się do węglanu po podgrzaniu:
Li2CO3+ CO2 + H2O →2lihco3
wodorowęglanu nie można oddzielić w stanie stałym forma. Występuje tylko w roztworze, gdy węglan rozpuszcza się w wodzie nasyconej pod ciśnieniem CO2.
właściwości chemiczne
węglan litu jest białym higroskopijnym proszkiem.
właściwości fizyczne
białe kryształy monokliniczne; współczynnik załamania światła 1,428; gęstość 2,11 g/cm3; topi się w 723°C; rozkłada się w 1,310°C; niska rozpuszczalność w wodzie (1,54 g/100 g) w 0°C; 1,32 g//100 g w 20°C), Rozpuszczalność spada wraz z temperaturą (0,72 g/100 g w 100°C); nierozpuszczalny w acetonie i Etanol.
używa
najczęstszym lekiem litu jest węglan litu, który ma działanie antymanii. Zakłada się, że lit zmienia transport jonów sodu w neuronach, wpływając w ten sposób na zawartość międzykomórkową katecholamin, normalizując stan psychiczny i nie powodując ogólnego letargu. Stosuje się go w Stanach manii różnego pochodzenia, środkach zapobiegawczych oraz w leczeniu psychoz afektywnych.
zastosowania
węglan litu jest stosowany jako związek do produkcji metalikulitu. Węglan litu jest wynikiem leczenia spodumenu mineralnego kwasem siarkowym, a następnie dodania węglanu wapnia. Jest stosowany jako lek przeciwdepresyjny.
wykorzystuje
w produkcji szkliw na porcelanie ceramicznej i elektrycznej.
przygotowanie
węglan litu Wytwarza się przez wytrącanie litiumionu jonami węglanowymi z roztworu wodnego. Jeszcze innym procesem, który odbywa się na małej skali, jest reakcja roztworu wodorotlenku litu z gazowym dwutlenkiem węgla. Litowęglan wytrąca się i jest odzyskiwany z roztworu supernatantu.
definicja
węglan litu: białe ciało stałe, Li2CO3; r. d. 2.11; m.p. 723°C; rozkłada się około 1310°C. Jest wytwarzany komercyjnie przez obróbkę rudy kwasem siarkowym w temperaturze 250°C i dodanie produktu do roztworu siarczanu litu. Węglan jest następnie otrzymywany przez wytrącenie roztworem węglanu sodu.Węglan litu stosuje się w zapobieganiui leczeniu maniakalnych zaburzeń depresyjnych. Jest również stosowany przemysłowo w szkliwach ceramicznych.
wskazania
lit hamuje tarczycową inkorporację I – do Tg, jak również wydzielanie hormonów tarczycy, ale nie hamuje aktywności na+-i – symportera ani kumulacji I – w obrębie tarczycy. Lit oferuje noparticular przewagę nad lekami z klasy tionamidale może być stosowany do czasowej kontroli pacjentów tyreotoksykozyzyny, którzy są uczuleni zarówno na tionamidy, jak i jodek.
Nazwa handlowa
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid(JDS); Lithonate (Solvay Pharmaceuticals).
Opis ogólny
Litowęglan (Eskalit, Litan) i cytrynian litu(Cibalit-S) są solami dostępnymi w handlu w Stanach Zjednoczonych.
profil reaktywności
baza. Rozkładany przez kwasy wraz z ewolucją dwutlenku węgla. Fluor pali się gwałtownie w kontakcie z węglanem litu.
profil bezpieczeństwa
dane dotyczące działania rakotwórczego u ludzi. Trucizna drogą dootrzewnową i dożylną. Umiarkowanie toksyczny po spożyciu i podaniu podskórnym. Działanie ogólnoustrojowe człowieka po spożyciu: toksyczne psychozy, drżenia, zmiany w przyjmowaniu płynów, osłabienie mięśni, zwiększona objętość moczu, nudności lub wymioty, alergiczne zapalenie skóry. Wpływ na reprodukcję u ludzi po spożyciu: wpływ na noworodka, w tym zmiany w skali Apgar i inne środki lub skutki dla noworodków. Działanie teratogenne u ludzi poprzez spożycie: zaburzenia rozwojowe układu sercowo-naczyniowego, ośrodkowego układu nerwowego, układu mięśniowo-szkieletowego i pokarmowego. Eksperymentalny teratogen. Eksperymentalne efekty reprodukcyjne. Eksperymentalne rakotwórcze białaczki i nowotwory tarczycy. Raport z mutacji u ludzi. Stosowany w leczeniu psychoz maniakalno-depresyjnych. Niezgodny z fluorem. Zobacz też związki litu.
Synteza chemiczna
węglan litu syntetyzuje się przez reakcję soli litu z sodą lub potażem, a następnie oczyszcza sól, która nie jest łatwo rozpuszczalna .
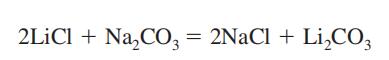
potencjalna ekspozycja
węglan litu jest stosowany w leczeniu psychoz maniakalno-depresyjnych; do produkcji ceramiki i glazury Porcelanowej; lakierów, barwników, farmaceutyków, powlekania elektrod spawalniczych; stopów baterii; nukleoniki, farby luminescencyjne; ceramiki szklanej; smarów; w produkcji aluminium
Wysyłka
Un2811 toksyczne ciała stałe, organiczne, N. O. S., klasa zagrożenia: 6.1; etykiety: 6.1-materiały trujące, wymagane techniczne
metody oczyszczania
krystalizują je z wody. Jego rozpuszczalność maleje wraz ze wzrostem temperatury. Rozpuszczalność w H2O wynosi 1,3% przy ~10o i 0,7% przy ~100o.
niezgodności
wodny roztwór jest silną zasadą.Reaguje gwałtownie z kwasami, sproszkowanym wapniem i fluorem.Niekompatybilny z utleniaczami (chlorany, azotany, nadtlenki, nadmanganiany, nadchlorany, chlor, brom,fluor itp.); kontakt może spowodować pożar lub wybuch. Przechowywać z dala od materiałów alkalicznych, silnych kwasów, sproszkowanego wapnia, fluoru, wilgoci. Koroduje aluminium, miedź, cynk.