- lithiumcarbonat kemiske egenskaber,anvendelser,produktion
- beskrivelse
- kemiske egenskaber
- bruger
- toksicitet
- præparat
- reaktioner
- kemiske egenskaber
- fysiske egenskaber
- bruger
- anvendelser
- bruger
- præparat
- Definition
- indikationer
- mærkenavn
- generel beskrivelse
- Reaktivitetsprofil
- sikkerhedsprofil
- kemisk syntese
- potentiel eksponering
- forsendelse
- rensningsmetoder
- uforligeligheder
lithiumcarbonat kemiske egenskaber,anvendelser,produktion
beskrivelse
lithiumcarbonat (molekylær struktur er Li2CO3, engelsk navn er lithiumcarbonat) som en farveløs monoklinisk krystal eller hvidt pulver. Tætheden er 2,11. Smeltepunkt er 618 liter. Uden vildfarelse er den stabil i luften. Lav opløselighed i vand, opløseligheden falder med stigende temperatur. Opløselighed i koldt vand er større end varmt vand. Det er opløseligt i fortyndet syre, uopløseligt i alkohol og acetone. I den vandige suspension af lithiumcarbonat, lithiumcarbonat omdannes til lithiumsyrekarbonat og opløses. Hvis opløsningen af lithiumsyrekarbonat opvarmes, frigiver den kulsyre og udfælder lithiumcarbonat. Lithiumcarbonatets art kan anvendes til at fjerne urenheder fra lithiumcarbonat. Da lithiumion har en stærk polariserbarhed, er termisk stabilitet af lithiumcarbonat således værre end andet alkalimetalcarbonat, når det opvarmes til over smeltepunktet, vil det nedbrydes for at producere kulsyre og lithiumilte.
kemiske egenskaber
lithiumcarbonat er et hvidt monoklinisk krystallinsk fast stof. Typisk for carbonater reagerer lithiumcarbonat med syrer, der er stærkere end kulsyre eller kulsyre for at give lithiumsaltet af syren og kulsyre. Reaktionerne kan udføres i en opløsning, som en vandig opslæmning, eller, mindre effektivt, med fast lithiumcarbonat.
lithiumcarbonat udviser en lav vandopløselighed for et alkalimetalcarbonat. Opløseligheden falder med stigende temperatur. Det er ikke hygroskopisk og er generelt stabilt, når det udsættes for atmosfæren. Faktisk er det den normale slutforbindelse, der opstår, når mange basiske lithiumforbindelser udsættes for atmosfæren. Lithiumcarbonat kan opløses i vand ved omdannelse til hydrogencarbonatet. Frigivelse af kulsyre ved opvarmning af opløsningen af lithiumhydrogencarbonat forårsager genudfældning af lithiumcarbonatet.
bruger
lithiumcarbonatindustrien er en global højmonopolindustri, den nuværende produktionskapacitet er hovedsageligt koncentreret i tre udenlandske producenter af KVM, FMC, Chemetall og så videre.
industrielt lithiumcarbonat anvendes til fremstilling af andre lithiumsalte, såsom lithiumchlorid og lithiumbromid og så videre. Det fungerer også som lithiumoksidmaterialer i emalje, glas, keramik og porcelænsemalje, og det tilsættes også til den elektrolytiske celle til elektrolyse af aluminium for at øge den aktuelle effektivitet og reducere cellens indre modstand og badetemperaturen. I medicin bruges det hovedsageligt til behandling af mani, kan forbedre deres følelsesmæssige lidelser for schisofreni. Det har den virkning at hæve perifere leukocytter; kan bruges til syntetisk gummi, farvestoffer, halvleder og militær forsvarsindustri og så videre; til fremstilling af lithiumtantalat, lithiumniobat og anden akustisk kvalitet enkeltkrystal, optisk kvalitet monokrystallinsk osv.til fremstilling af den akustiske kvalitet enkeltkrystal.
batterikvalitet lithiumcarbonat anvendes hovedsageligt til fremstilling af lithiumkoboltfilter, lithiummanganfilter, ternære materialer, lithiumjernphosphat og andre lithiumionbatterikatodematerialer; anvendes i en matricsmodifikator; som enbeskyttende virkning af lithiumcarbonat i amyotrofisk lateral sklerose.
toksicitet
lithiumcarbonat har en signifikant stimulerende virkning, for det første har skade på mave-tarmkanalen, nyrerne og centralnervesystemet. Toksicitetsrækkefølgen for lithiumforbindelser er Li <LiCl< Li2CO3, maksimal tilladt koncentration: Lithiumkondensation og fragmenteringsspray var 0,05 mg/m3 og 0,5 mg / m3.
brug gummihandsker og beskyttelsesmasker, når du arbejder, for at beskytte åndedrætsorganerne mod støv.
præparat
lithiumcarbonat fremstilles som et mellemprodukt ved genvinding af lithiummetal fra dets malm, spodumen (se Lithium). Den fremstilles ved at blande en varm og koncentreret opløsning af natriumcarbonat med lithiumchlorid eller sulfatopløsning.
Li2SO4 + Na2CO3 Li2co3 + Na2SO4
reaktioner
lithiumcarbonat reagerer med fortyndede syrer, frigørende kulsyre:
Li2CO3 + HCI LiCl + CO2 + H2O
termisk nedbrydning giver lithiumilte og kulsyre:
Li2CO3 Li2o + CO2
reaktion med kalk producerer lithiumhydroksid:
Li2CO3+ Ca(OH)2 lilioh + CaCO3
karbonatet reagerer med smeltet aluminiumfluorid, der omdannes til lithiumfluorid:
3li2co3+ 2alf3 lilif 6LiF + 3co2+ Al2O3
det kombineres med kulsyre i vandig opslæmning, der danner opløseligt bicarbonat, som nedbrydes til carbonat ved opvarmning:
Li2CO3+ CO2+ H2O Lili 2LiHCO3
bicarbonatet kan ikke adskilles i fast form. Den findes kun i opløsning, når carbonat opløses i vand mættet med CO2under tryk.
kemiske egenskaber
lithiumcarbonat er et hvidt hygroskopisk pulver.
fysiske egenskaber
hvide monokliniske krystaller; brydningsindeks 1,428; densitet 2,11 g/cm3; smelter ved 723 liter C; nedbrydes ved 1.310 liter C; lav opløselighed i vand (1,54 g/100 g) ved 0 liter C; 1,32 g//100 g ved 20 liter C), opløseligheden falder med temperatur (0,72 g/100 g ved 100 liter C); uopløselig i acetone og ethanol.
bruger
det mest almindelige lithiumlægemiddel er lithiumcarbonat, som besidder antimaniavirkning. Det antages, at lithium ændrer transporten af natriumioner i neuroner og dermed påvirker det intercellulære indhold af catecholaminer, normaliserer den mentale tilstand og ikke forårsagergenerel sløvhed. Det bruges til maniske tilstande af forskellig oprindelse, forebyggende foranstaltninger og til behandling af affektive psykoser.
anvendelser
lithiumcarbonat anvendes som en forbindelse til fremstilling af metalliclithium. Lithiumcarbonat er resultatet af behandling af mineralet spodumen med svovlsyre og derefter tilsætning af calciumcarbonat. Det bruges som et antidepressivt middel.
bruger
til fremstilling af glasurer på keramik og elektrisk porcelæn.
præparat
lithiumcarbonat fremstilles ved udfældning af lithiumion ved carbonation fra en vandig opløsning. Endnu en anden proces, som udføres på en mindreskala, er reaktionen af en opløsning af lithiumhydroksid med kulsyre. Lithiumcarbonat udfældes og udvindes fra supernatantopløsningen.
Definition
lithiumcarbonat: et hvidt fast stof,Li2CO3; r. D.2.11; m. p. 723 liter C; nedbrydes over 1310 liter C. Den fremstilles kommercielt ved at behandle malmen med svovlsyre ved 250 C oglaske produktet for at give en opløsning af lithiumsulfat. Carbonatetopnås derefter ved udfældningmed natriumcarbonatopløsning.Lithiumcarbonat anvendes til forebyggelseog behandling af manicdepressivlidelser. Det bruges ogsåindustrielt i keramiske glasurer.
indikationer
Lithium hæmmer thyroidal inkorporering af I – i Tg såvel som udskillelsen af skjoldbruskkirtelhormoner, men det hæmmer ikke aktiviteten af Na+-i – symporter ellerophobning af i – i skjoldbruskkirtlen. Lithium tilbyder nopartikulær fordel i forhold til lægemidler i thionamidklassenmen kan anvendes til midlertidig kontrol af thyrotoksicosehos patienter, der er allergiske over for både thionamiderog iodid.
Eskalith (Glakosmithkline); Lithane (Bayer); Lithobid(JDS); Lithonat (Solvay Pharmaceuticals).
generel beskrivelse
lithiumcarbonat (Eskalith, Lithane) og lithiumcitrat(Cibalith-s) er de salte, der er kommercielt tilgængelige i De Forenede Stater.
Reaktivitetsprofil
en base. Dekomponeret af syrer med udviklingen af kulsyre. Fluor brænder voldsomt ved kontakt med lithiumcarbonat.
sikkerhedsprofil
humane carcinogene data. Gift ved intraperitoneal og intravenøs vej. Moderat toksisk ved indtagelse og subkutan administration. Humane systemiske virkninger ved indtagelse: giftig psykose, rysten, ændringer i væskeindtag, muskelsvaghed, øget urinvolumen, kvalme eller opkast, allergisk dermatitis. Menneskelige reproduktive virkninger ved indtagelse: virkninger på nyfødte, herunder Apgar score ændringer og andre neonatale foranstaltninger eller virkninger. Humane teratogene virkninger ved indtagelse: udviklingsmæssige abnormiteter i det kardiovaskulære system, centralnervesystemet, muskuloskeletale og gastrointestinale systemer. Et eksperimentelt teratogen. Eksperimentelle reproduktive effekter. Eksperimentelt kræftfremkaldende stof, der producerer leukæmi og skjoldbruskkirteltumorer. Humane mutationsdata rapporteret. Anvendes til behandling af manisk-depressive psykoser. Uforenelig med fluor. Se også lithiumforbindelser.
kemisk syntese
lithiumcarbonat syntetiseres ved at reagere lithiumsalte med sodavandeller kaliumchlorid efterfulgt af oprensning af saltet, som ikke er letopløseligt .
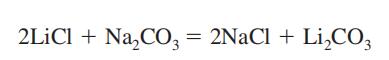
potentiel eksponering
lithiumcarbonat anvendes til behandling af manisk-depressive psykoser; at fremstille keramik og porcelænsglasur; lakker, farvestoffer, lægemidler, belægning afarc-svejseelektroder; batterilegeringer; nukleonik, selvlysende maling; glaskeramik; smørefedt; i aluminiumsproduktion
forsendelse
UN2811 giftige faste stoffer, organiske, n.o.s., fareklasse: 6.1; etiketter: 6.1-giftige materialer, teknisk navn påkrævet
rensningsmetoder
krystalliser det fra vand. Dens opløselighed falder, når temperaturen hæves. Opløseligheden i H2O er 1,3% ved ~10o og 0,7% ved ~100o.
uforligeligheder
den vandige opløsning er en stærk base.Reagerer voldsomt med syrer, pulveriseret calcium og fluor.Hvis det er nødvendigt, kan det være nødvendigt at anvende en sådan metode.); kontakt kan forårsage brand eller eksplosioner. Hold vækfra alkaliske materialer, Stærke syrer,pulveriseret calcium, fluor, fugt. Korroderer aluminium, kobber.