 Wir haben schon einmal über Ionen gesprochen. Jetzt ist es Zeit, zu den Grundlagen zu kommen. Die Ordnungszahl eines Elements, auch Protonenzahl genannt, gibt die Anzahl der Protonen oder positiven Teilchen in einem Atom an. Ein normales Atom hat eine neutrale Ladung mit gleicher Anzahl positiver und negativer Teilchen. Das bedeutet, dass ein Atom mit neutraler Ladung eines ist, bei dem die Anzahl der Elektronen gleich der Ordnungszahl ist. Ionen sind Atome mit zusätzlichen Elektronen oder fehlenden Elektronen. Wenn Ihnen ein oder zwei Elektronen fehlen, haben Sie eine positive Ladung. Wenn Sie ein oder zwei zusätzliche Elektronen haben, haben Sie eine negative Ladung.
Wir haben schon einmal über Ionen gesprochen. Jetzt ist es Zeit, zu den Grundlagen zu kommen. Die Ordnungszahl eines Elements, auch Protonenzahl genannt, gibt die Anzahl der Protonen oder positiven Teilchen in einem Atom an. Ein normales Atom hat eine neutrale Ladung mit gleicher Anzahl positiver und negativer Teilchen. Das bedeutet, dass ein Atom mit neutraler Ladung eines ist, bei dem die Anzahl der Elektronen gleich der Ordnungszahl ist. Ionen sind Atome mit zusätzlichen Elektronen oder fehlenden Elektronen. Wenn Ihnen ein oder zwei Elektronen fehlen, haben Sie eine positive Ladung. Wenn Sie ein oder zwei zusätzliche Elektronen haben, haben Sie eine negative Ladung. Was tun Sie, wenn Sie ein Natriumatom (Na) sind? Sie haben elf Elektronen – eines zu viel, um eine ganze Schale gefüllt zu haben. Sie müssen ein anderes Element finden, das Ihnen dieses Elektron wegnimmt. Wenn Sie dieses Elektron verlieren, werden Sie volle Schalen haben. Wann immer ein Atom volle Schalen hat, sagen wir, es ist „glücklich.“ Schauen wir uns Chlor (Cl) an. Chlor hat siebzehn Elektronen und braucht nur noch eines, um seine dritte Schale zu füllen und „glücklich“ zu sein.“ Chlor nimmt Ihr zusätzliches Natriumelektron und hinterlässt 10 Elektronen in zwei gefüllten Schalen. Du bist jetzt auch ein glückliches Atom. Du bist auch ein Ion und es fehlt ein Elektron. Das fehlende Elektron gibt Ihnen eine positive Ladung. Du bist immer noch das Element Natrium, aber du bist jetzt ein Natriumion (Na +). Sie haben ein Elektron weniger als Ihre Atomzahl.
Was tun Sie, wenn Sie ein Natriumatom (Na) sind? Sie haben elf Elektronen – eines zu viel, um eine ganze Schale gefüllt zu haben. Sie müssen ein anderes Element finden, das Ihnen dieses Elektron wegnimmt. Wenn Sie dieses Elektron verlieren, werden Sie volle Schalen haben. Wann immer ein Atom volle Schalen hat, sagen wir, es ist „glücklich.“ Schauen wir uns Chlor (Cl) an. Chlor hat siebzehn Elektronen und braucht nur noch eines, um seine dritte Schale zu füllen und „glücklich“ zu sein.“ Chlor nimmt Ihr zusätzliches Natriumelektron und hinterlässt 10 Elektronen in zwei gefüllten Schalen. Du bist jetzt auch ein glückliches Atom. Du bist auch ein Ion und es fehlt ein Elektron. Das fehlende Elektron gibt Ihnen eine positive Ladung. Du bist immer noch das Element Natrium, aber du bist jetzt ein Natriumion (Na +). Sie haben ein Elektron weniger als Ihre Atomzahl. 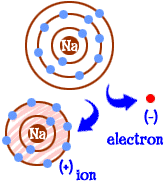 Jetzt bist du also ein Natriumion geworden. Sie haben zehn Elektronen. Das ist die gleiche Anzahl von Elektronen wie Neon (Ne). Aber du bist nicht Neon. Da Ihnen ein Elektron fehlt, sind Sie auch kein vollständiges Natriumatom. Als Ion bist du jetzt etwas völlig Neues. Ihr ganzes Ziel als Atom war es, ein „glückliches Atom“ mit vollständig gefüllten Elektronenhüllen zu werden. Jetzt haben Sie diese gefüllten Schalen. Sie haben eine niedrigere Energie. Sie haben ein Elektron verloren und sind „glücklich.“ Was macht dich für andere Atome interessant? Nun, da Sie das Elektron aufgegeben haben, sind Sie ziemlich elektrisch attraktiv. Andere elektrisch geladene Atome (Ionen) der entgegengesetzten Ladung (negativ) sehen Sie jetzt an und sehen einen guten Partner, mit dem Sie sich verbinden können. Hier kommt das Chlor ins Spiel. Es ist nicht nur Chlor. Fast jedes negativ geladene Ion ist daran interessiert, sich mit Ihnen zu verbinden.
Jetzt bist du also ein Natriumion geworden. Sie haben zehn Elektronen. Das ist die gleiche Anzahl von Elektronen wie Neon (Ne). Aber du bist nicht Neon. Da Ihnen ein Elektron fehlt, sind Sie auch kein vollständiges Natriumatom. Als Ion bist du jetzt etwas völlig Neues. Ihr ganzes Ziel als Atom war es, ein „glückliches Atom“ mit vollständig gefüllten Elektronenhüllen zu werden. Jetzt haben Sie diese gefüllten Schalen. Sie haben eine niedrigere Energie. Sie haben ein Elektron verloren und sind „glücklich.“ Was macht dich für andere Atome interessant? Nun, da Sie das Elektron aufgegeben haben, sind Sie ziemlich elektrisch attraktiv. Andere elektrisch geladene Atome (Ionen) der entgegengesetzten Ladung (negativ) sehen Sie jetzt an und sehen einen guten Partner, mit dem Sie sich verbinden können. Hier kommt das Chlor ins Spiel. Es ist nicht nur Chlor. Fast jedes negativ geladene Ion ist daran interessiert, sich mit Ihnen zu verbinden.
Elektrovalenz
Mach dir keine Sorgen um das große Wort. Elektrovalenz ist nur ein anderes Wort für etwas, das Elektronen aufgegeben oder aufgenommen und zu einem Ion geworden ist. Wenn Sie sich das Periodensystem ansehen, stellen Sie möglicherweise fest, dass Elemente auf der linken Seite normalerweise positiv geladene Ionen (Kationen) und Elemente auf der rechten Seite eine negative Ladung (Anionen) erhalten. Dieser Trend bedeutet, dass die linke Seite eine positive Valenz und die rechte Seite eine negative Valenz hat. Valenz ist ein Maß dafür, wie viel ein Atom mit anderen Atomen verbinden möchte. Es ist auch ein Maß dafür, wie viele Elektronen über die Bindung mit anderen Atomen angeregt werden.
Es gibt zwei Hauptarten der Bindung, kovalent und elektrovalent. Sie haben vielleicht von dem Begriff „ionische Bindungen“ gehört.“ Ionische Bindungen sind elektrovalente Bindungen. Sie sind nur Gruppen geladener Ionen, die durch elektrische Kräfte zusammengehalten werden. Wissenschaftler nennen diese Gruppen „ionische Agglomerate.“ In Gegenwart anderer Ionen sind die elektrovalenten Bindungen aufgrund äußerer elektrischer Kräfte und Anziehungen schwächer. Natrium- und Chlorionen allein haben eine sehr starke Bindung, aber sobald Sie diese Ionen in eine Lösung mit H + -, OH-, F- oder Mg ++ – Ionen geben, gibt es geladene Ablenkungen, die die Na-Cl-Bindung aufbrechen.
Schauen Sie sich noch einmal Natriumchlorid (NaCl) an. Salz ist eine sehr starke Bindung, wenn es auf Ihrem Tisch sitzt. Es wäre fast unmöglich, diese ionischen / elektrovalenten Bindungen zu brechen. Wenn Sie dieses Salz jedoch in etwas Wasser (H2O) geben, brechen die Bindungen sehr schnell. Dies geschieht leicht aufgrund der elektrischen Anziehung des Wassers. Jetzt schwimmen Natrium- (Na +) und Chlor- (Cl-) Ionen um die Lösung herum. Sie sollten daran denken, dass ionische Bindungen normalerweise stark sind, aber in Wasser sehr schwach sind.
Zugehöriges Video…
Wikipedia: Ionen
Encyclopedia.com : Ionen