 we’ve talked about ions before. Agora é hora de passar ao básico. O número atômico de um elemento, também chamado de número de prótons, lhe diz O número de prótons ou partículas positivas em um átomo. Um átomo normal tem uma carga neutra com números iguais de partículas positivas e negativas. Isso significa que um átomo com uma carga neutra é aquele em que o número de elétrons é igual ao número atômico. Íons são átomos com elétrons extras ou elétrons em falta. Quando você está perdendo um elétron ou dois, você tem uma carga positiva. Quando você tem um elétron extra ou dois, você tem uma carga negativa.
we’ve talked about ions before. Agora é hora de passar ao básico. O número atômico de um elemento, também chamado de número de prótons, lhe diz O número de prótons ou partículas positivas em um átomo. Um átomo normal tem uma carga neutra com números iguais de partículas positivas e negativas. Isso significa que um átomo com uma carga neutra é aquele em que o número de elétrons é igual ao número atômico. Íons são átomos com elétrons extras ou elétrons em falta. Quando você está perdendo um elétron ou dois, você tem uma carga positiva. Quando você tem um elétron extra ou dois, você tem uma carga negativa.
 What do you do if you are a sodium (na) atom? Você tem onze elétrons — um a mais para ter uma concha inteira preenchida. Tens de encontrar outro elemento que te tire esse electrão. Quando perderes esse electrão, terás conchas cheias. Sempre que um átomo tem conchas cheias, dizemos que é “feliz.”Let’s look at chlorine (Cl). O cloro tem dezessete elétrons e só precisa de mais um para preencher sua terceira concha e ser “feliz.”O cloro vai pegar no teu electrão de sódio extra e deixar-te com 10 electrões dentro de duas conchas cheias. Agora também és um átomo feliz. Você também é um íon e falta um elétron. Aquele electrão desaparecido dá-te uma carga positiva. Você ainda é o elemento sódio, mas você é agora um íon de sódio (na+). Tens menos um electrão do que o teu número atómico.
What do you do if you are a sodium (na) atom? Você tem onze elétrons — um a mais para ter uma concha inteira preenchida. Tens de encontrar outro elemento que te tire esse electrão. Quando perderes esse electrão, terás conchas cheias. Sempre que um átomo tem conchas cheias, dizemos que é “feliz.”Let’s look at chlorine (Cl). O cloro tem dezessete elétrons e só precisa de mais um para preencher sua terceira concha e ser “feliz.”O cloro vai pegar no teu electrão de sódio extra e deixar-te com 10 electrões dentro de duas conchas cheias. Agora também és um átomo feliz. Você também é um íon e falta um elétron. Aquele electrão desaparecido dá-te uma carga positiva. Você ainda é o elemento sódio, mas você é agora um íon de sódio (na+). Tens menos um electrão do que o teu número atómico.
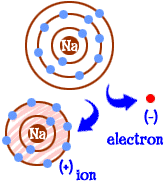 So now you’ve become a sodium ion. Tens dez electrões. É o mesmo número de elétrons que o néon (Ne). Mas tu não és o neon. Como te falta um electrão, também não és um átomo de sódio completo. Como um íon você é agora algo completamente novo. Seu objetivo como um átomo era tornar-se um” átomo feliz ” com camadas elétricas completamente cheias. Agora tens as conchas cheias. Tens uma energia mais baixa. Perdeste um electrão e estás feliz.”Então, o que te torna interessante para outros átomos? Agora que você desistiu do elétron, você é muito eletricamente atraente. Outros átomos eletricamente carregados (íons) da carga oposta (negativo) estão agora olhando para você e vendo um bom parceiro com quem se ligar. É aí que entra o cloro. Não é só cloro. Quase qualquer íon com uma carga negativa estará interessado em criar laços contigo.
So now you’ve become a sodium ion. Tens dez electrões. É o mesmo número de elétrons que o néon (Ne). Mas tu não és o neon. Como te falta um electrão, também não és um átomo de sódio completo. Como um íon você é agora algo completamente novo. Seu objetivo como um átomo era tornar-se um” átomo feliz ” com camadas elétricas completamente cheias. Agora tens as conchas cheias. Tens uma energia mais baixa. Perdeste um electrão e estás feliz.”Então, o que te torna interessante para outros átomos? Agora que você desistiu do elétron, você é muito eletricamente atraente. Outros átomos eletricamente carregados (íons) da carga oposta (negativo) estão agora olhando para você e vendo um bom parceiro com quem se ligar. É aí que entra o cloro. Não é só cloro. Quase qualquer íon com uma carga negativa estará interessado em criar laços contigo.
Electrovalência
não se preocupe com a palavra grande. Eletrovalência é apenas outra palavra para algo que desistiu ou tomou elétrons e se tornou um íon. Se você olhar para a tabela periódica, você pode notar que os elementos do lado esquerdo geralmente se tornam íons carregados positivamente (catiões) e os elementos do lado direito recebem uma carga negativa (aniões). Essa tendência significa que o lado esquerdo tem uma valência positiva e o lado direito tem uma valência negativa. A valência é uma medida do quanto um átomo quer ligar-se a outros átomos. É também uma medida de quantos elétrons estão excitados sobre a ligação com outros átomos.
There are two main types of bonding, covalent and electrovalent. Deves ter ouvido falar do termo “laços iónicos”.”As ligações iónicas são ligações electrovalentes. Eles são apenas grupos de íons carregados juntos por forças elétricas. Os cientistas chamam esses grupos de aglomerados iônicos.”Quando na presença de outros íons, as ligações eletrovalentes são mais fracas por causa de forças elétricas externas e atrações. Só os iões de sódio e cloro têm uma ligação muito forte, mas assim que se colocam esses iões numa solução com iões H+, OH-, F – ou Mg++, há distrações carregadas que quebram a ligação Na-Cl.
Look at sodium chloride (NaCl) one more time. O sal é uma ligação muito forte quando está sentado na sua mesa. Seria quase impossível quebrar essas ligações iónicas / electrovalentes. No entanto, se você colocar esse sal em alguma água (H2O), as ligações quebram muito rapidamente. Acontece facilmente por causa da atração elétrica da água. Agora você tem íons de sódio (na+) e cloro (Cl-) flutuando em torno da solução. Você deve lembrar que as ligações iônicas são normalmente fortes, mas eles são muito fracos na água.
vídeo relacionado…
Wikipedia: Ions
Encyclopedia.com: Ions