 olemme puhuneet ioneista ennenkin. Nyt on aika siirtyä perusasioihin. Alkuaineen järjestysluku, jota kutsutaan myös protoniluvuksi, kertoo atomissa olevien protonien tai positiivisten hiukkasten määrän. Normaalilla atomilla on neutraalivaraus, jossa on yhtä monta positiivista ja negatiivista hiukkasta. Se tarkoittaa, että atomi, jolla on neutraali varaus, on sellainen, jossa elektronien lukumäärä on yhtä suuri kuin järjestysluku. Ionit ovat atomeja, joilla on ylimääräisiä elektroneja tai puuttuvat elektronit. Kun puuttuu elektroni tai kaksi, on positiivinen varaus. Kun on ylimääräinen elektroni tai kaksi, on negatiivinen varaus.
olemme puhuneet ioneista ennenkin. Nyt on aika siirtyä perusasioihin. Alkuaineen järjestysluku, jota kutsutaan myös protoniluvuksi, kertoo atomissa olevien protonien tai positiivisten hiukkasten määrän. Normaalilla atomilla on neutraalivaraus, jossa on yhtä monta positiivista ja negatiivista hiukkasta. Se tarkoittaa, että atomi, jolla on neutraali varaus, on sellainen, jossa elektronien lukumäärä on yhtä suuri kuin järjestysluku. Ionit ovat atomeja, joilla on ylimääräisiä elektroneja tai puuttuvat elektronit. Kun puuttuu elektroni tai kaksi, on positiivinen varaus. Kun on ylimääräinen elektroni tai kaksi, on negatiivinen varaus. mitä teet, jos olet natriumatomi (Na)? Sinulla on yksitoista elektronia — yksi liikaa, jotta kokonainen kuori täyttyisi. Etsi toinen alkuaine, joka vie elektronin sinulta. Kun menetätte elektronin, teillä on täydet kuoret. Aina kun atomilla on täydet kuoret, sanomme sen olevan ”onnellinen.”Katsotaanpa klooria (Cl). Kloorilla on seitsemäntoista elektronia ja tarvitsee vain yhden lisää täyttääkseen kolmannen kuorensa ja ollakseen ”onnellinen.”Kloori vie ylimääräisen natriumelektronisi ja jättää sinulle 10 elektronia kahden täytetyn kuoren sisään. Sinäkin olet nyt onnellinen atomi. Olet myös ioni ja puuttuu yksi elektroni. Puuttuva elektroni antaa positiivisen varauksen. Olet edelleen alkuaine natrium, mutta olet nyt natriumioni (Na+). Sinulla on yksi elektroni vähemmän kuin järjestysluvullasi.
mitä teet, jos olet natriumatomi (Na)? Sinulla on yksitoista elektronia — yksi liikaa, jotta kokonainen kuori täyttyisi. Etsi toinen alkuaine, joka vie elektronin sinulta. Kun menetätte elektronin, teillä on täydet kuoret. Aina kun atomilla on täydet kuoret, sanomme sen olevan ”onnellinen.”Katsotaanpa klooria (Cl). Kloorilla on seitsemäntoista elektronia ja tarvitsee vain yhden lisää täyttääkseen kolmannen kuorensa ja ollakseen ”onnellinen.”Kloori vie ylimääräisen natriumelektronisi ja jättää sinulle 10 elektronia kahden täytetyn kuoren sisään. Sinäkin olet nyt onnellinen atomi. Olet myös ioni ja puuttuu yksi elektroni. Puuttuva elektroni antaa positiivisen varauksen. Olet edelleen alkuaine natrium, mutta olet nyt natriumioni (Na+). Sinulla on yksi elektroni vähemmän kuin järjestysluvullasi. 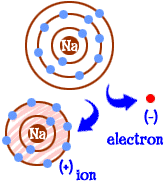 joten nyt olet muuttunut natriumioniksi. Sinulla on kymmenen elektronia. Se on sama määrä elektroneja kuin neon (Ne). Mutta sinä et ole neon. Koska sinulta puuttuu elektroni, et ole myöskään täydellinen natriumatomi. Ionina olet nyt jotain aivan uutta. Koko tavoitteesi atomina oli tulla ”onnelliseksi atomiksi”, jolla olisi täysin täytetyt elektronikuoret. Nyt sinulla on niitä täytettyjä kuoria. Sinulla on vähemmän energiaa. Menetit elektronin ja olet ”onnellinen.”Mikä tekee sinusta kiinnostavan muille atomeille? Nyt kun olet luovuttanut elektronin, olet melko sähköisesti houkutteleva. Muut sähköisesti varautuneet atomit (ionit) vastakkaisesta varauksesta (negatiivinen) katsovat nyt sinua ja näkevät hyvän kumppanin, jonka kanssa sitoutua. Siinä kloori astuu kuvaan. Se ei ole vain klooria. Lähes jokainen ioni, jolla on negatiivinen varaus, on kiinnostunut sitoutumaan sinuun.
joten nyt olet muuttunut natriumioniksi. Sinulla on kymmenen elektronia. Se on sama määrä elektroneja kuin neon (Ne). Mutta sinä et ole neon. Koska sinulta puuttuu elektroni, et ole myöskään täydellinen natriumatomi. Ionina olet nyt jotain aivan uutta. Koko tavoitteesi atomina oli tulla ”onnelliseksi atomiksi”, jolla olisi täysin täytetyt elektronikuoret. Nyt sinulla on niitä täytettyjä kuoria. Sinulla on vähemmän energiaa. Menetit elektronin ja olet ”onnellinen.”Mikä tekee sinusta kiinnostavan muille atomeille? Nyt kun olet luovuttanut elektronin, olet melko sähköisesti houkutteleva. Muut sähköisesti varautuneet atomit (ionit) vastakkaisesta varauksesta (negatiivinen) katsovat nyt sinua ja näkevät hyvän kumppanin, jonka kanssa sitoutua. Siinä kloori astuu kuvaan. Se ei ole vain klooria. Lähes jokainen ioni, jolla on negatiivinen varaus, on kiinnostunut sitoutumaan sinuun.
Elektrovalenssi
älä huolestu isosta sanasta. Elektrovalenssi on vain yksi sana jollekin, joka on luovuttanut tai ottanut elektroneja ja muuttunut ioniksi. Jaksollista järjestelmää tarkastellessa saattaa huomata, että vasemmalla puolella olevat alkuaineet muuttuvat yleensä positiivisesti varautuneiksi ioneiksi (kationeiksi) ja oikealla puolella olevat alkuaineet saavat negatiivisen varauksen (anionit). Tämä suuntaus tarkoittaa, että vasemmalla puolella on positiivinen valenssi ja oikealla puolella on negatiivinen valenssi. Valenssi on mitta siitä, kuinka paljon atomi haluaa sitoutua muihin atomeihin. Se on myös mitta siitä, kuinka monta elektronia innostuu sitoutumisesta muiden atomien kanssa.
sidosaineita on kahta päätyyppiä, kovalenttisia ja elektrovalentteja. Olet ehkä kuullut termistä ” ionisidokset.”Ionisidokset ovat elektrovalentteja sidoksia. Ne ovat vain varautuneiden ionien ryhmiä, joita sähkövoimat pitävät koossa. Tutkijat kutsuvat näitä ryhmiä ” ionisiksi agglomeraateiksi.”Muiden ionien läsnä ollessa elektrovalenttisidokset ovat heikompia ulkopuolisten sähköisten voimien ja houkutusten vuoksi. Pelkillä natrium-ja kloori-ioneilla on erittäin vahva sidos, mutta heti kun laitat nämä ionit h+ -, OH -, F-tai Mg++ – ionien liuokseen, on latautuneita häiriötekijöitä, jotka rikkovat Na-Cl-sidoksen.
Katso natriumkloridia (NaCl) vielä kerran. Suola on hyvin vahva side, kun se istuu pöydälläsi. Ionien ja elektrovalenttien sidosten katkeaminen olisi lähes mahdotonta. Jos kuitenkin laitat suolan johonkin veteen (H2O), sidokset katkeavat hyvin nopeasti. Se tapahtuu helposti, koska sähköinen vetovoima veden. Nyt liuoksen ympärillä leijuu natrium – (Na+) ja kloori – (Cl -) ioneja. Kannattaa muistaa, että ionisidokset ovat normaalisti vahvoja, mutta vedessä ne ovat hyvin heikkoja.
► tai etsi sivustoilta…
aiheeseen liittyvä Video…
Wikipedia: Ions
Encyclopedia.com: Ions