 už Jsme mluvili o ionty předtím. Nyní je čas se dostat k základům. Atomové číslo prvku, nazývané také protonové číslo, vám říká počet protonů nebo pozitivních částic v atomu. Normální atom má neutrální náboj se stejným počtem pozitivních a negativních částic. To znamená, že atom s neutrálním nábojem je atom, kde se počet elektronů rovná atomovému číslu. Ionty jsou atomy s extra elektrony nebo chybějícími elektrony. Když vám chybí elektron nebo dva, máte kladný náboj. Když máte elektron nebo dva navíc, máte záporný náboj.
už Jsme mluvili o ionty předtím. Nyní je čas se dostat k základům. Atomové číslo prvku, nazývané také protonové číslo, vám říká počet protonů nebo pozitivních částic v atomu. Normální atom má neutrální náboj se stejným počtem pozitivních a negativních částic. To znamená, že atom s neutrálním nábojem je atom, kde se počet elektronů rovná atomovému číslu. Ionty jsou atomy s extra elektrony nebo chybějícími elektrony. Když vám chybí elektron nebo dva, máte kladný náboj. Když máte elektron nebo dva navíc, máte záporný náboj. co děláte, pokud jste atom sodíku (Na)? Máte jedenáct elektronů-jeden příliš mnoho na to, aby byla naplněna celá skořápka. Musíte najít jiný prvek, který vám tento elektron odnese. Když ten elektron ztratíte, budete mít plné náboje. Kdykoli má atom plné skořápky, říkáme, že je “ šťastný.“Podívejme se na chlor (Cl). Chlor má sedmnáct elektronů a potřebuje ještě jeden, aby naplnil svůj třetí plášť a byl „šťastný.“Chlor vezme váš další sodíkový elektron a nechá vás s 10 elektrony uvnitř dvou naplněných skořápek. Nyní jste také šťastný atom. Jste také ion a chybí jeden elektron. Ten chybějící elektron vám dává kladný náboj. Stále jste prvkem sodíku, ale nyní jste sodným iontem (Na+). Máte o jeden elektron méně než vaše atomové číslo.
co děláte, pokud jste atom sodíku (Na)? Máte jedenáct elektronů-jeden příliš mnoho na to, aby byla naplněna celá skořápka. Musíte najít jiný prvek, který vám tento elektron odnese. Když ten elektron ztratíte, budete mít plné náboje. Kdykoli má atom plné skořápky, říkáme, že je “ šťastný.“Podívejme se na chlor (Cl). Chlor má sedmnáct elektronů a potřebuje ještě jeden, aby naplnil svůj třetí plášť a byl „šťastný.“Chlor vezme váš další sodíkový elektron a nechá vás s 10 elektrony uvnitř dvou naplněných skořápek. Nyní jste také šťastný atom. Jste také ion a chybí jeden elektron. Ten chybějící elektron vám dává kladný náboj. Stále jste prvkem sodíku, ale nyní jste sodným iontem (Na+). Máte o jeden elektron méně než vaše atomové číslo. 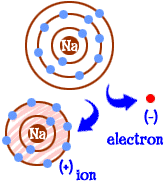 takže teď jste se stal iontem sodíku. Máte deset elektronů. To je stejný počet elektronů jako neon (Ne). Ale ty nejsi neon. Protože vám chybí elektron, nejste ani úplným atomem sodíku. Jako ion jste nyní něco zcela nového. Vaším cílem jako atomu bylo stát se „šťastným atomem“ se zcela naplněnými elektronovými skořápkami. Nyní máte ty naplněné skořápky. Máte nižší energii. Ztratili jste elektron a jste “ šťastní.“Co vás dělá zajímavým pro jiné atomy? Nyní, když jste se vzdali elektronu, jste docela elektricky atraktivní. Jiné elektricky nabité atomy (ionty) opačný náboj (negativní) jsou teď na tebe dívá a vidí dobrého partnera se spojit se. Tam přichází chlor. Není to jen chlor. Téměř každý ion s negativním nábojem bude mít zájem o spojení s vámi.
takže teď jste se stal iontem sodíku. Máte deset elektronů. To je stejný počet elektronů jako neon (Ne). Ale ty nejsi neon. Protože vám chybí elektron, nejste ani úplným atomem sodíku. Jako ion jste nyní něco zcela nového. Vaším cílem jako atomu bylo stát se „šťastným atomem“ se zcela naplněnými elektronovými skořápkami. Nyní máte ty naplněné skořápky. Máte nižší energii. Ztratili jste elektron a jste “ šťastní.“Co vás dělá zajímavým pro jiné atomy? Nyní, když jste se vzdali elektronu, jste docela elektricky atraktivní. Jiné elektricky nabité atomy (ionty) opačný náboj (negativní) jsou teď na tebe dívá a vidí dobrého partnera se spojit se. Tam přichází chlor. Není to jen chlor. Téměř každý ion s negativním nábojem bude mít zájem o spojení s vámi.
Elektrovalence
nedělejte si starosti s velkým slovem. Elektrovalence je jen další slovo pro něco, co se vzdalo nebo vzalo elektrony a stalo se iontem. Pokud se podíváte do periodické tabulky, můžete si všimnout, že prvky na levé straně se obvykle stávají kladně nabité ionty (kationty) a prvky na pravé straně záporný náboj (anionty). Tento trend znamená, že levá strana má kladnou valenci a pravá strana má zápornou valenci. Valence je měřítkem toho, kolik se atom chce spojit s jinými atomy. Je také měřítkem toho, kolik elektronů je vzrušeno vazbou s jinými atomy.
existují dva hlavní typy vazby, kovalentní a elektrovalentní. Možná jste slyšeli o termínu “ iontové vazby.“Iontové vazby jsou elektrovalentní vazby. Jsou to jen skupiny nabitých iontů držených pohromadě elektrickými silami. Vědci nazývají tyto skupiny “ iontové aglomeráty.“Když jsou v přítomnosti jiných iontů, jsou elektrovalentní vazby slabší kvůli vnějším elektrickým silám a přitažlivosti. Samotné ionty sodíku a chloru mají velmi silnou vazbu, ale jakmile tyto ionty vložíte do roztoku s ionty H+, OH-, F – nebo Mg++, jsou nabité rozptýlení, které narušují vazbu Na-Cl.
Podívejte se na chlorid sodný (NaCl) ještě jednou. Sůl je velmi silné pouto, když sedí na stole. Bylo by téměř nemožné tyto iontové/elektrovalentní vazby zlomit. Pokud však tuto sůl vložíte do nějaké vody (H2O), vazby se velmi rychle rozbijí. Stává se to snadno kvůli elektrické přitažlivosti vody. Nyní máte kolem roztoku plovoucí ionty sodíku (na+) a chloru (Cl -). Měli byste si uvědomit, že iontové vazby jsou obvykle silné, ale ve vodě jsou velmi slabé.
související Video…
Wikipedie: Ionty
Encyclopedia.com: Ionty