 Nous avons déjà parlé d’ions. Il est maintenant temps de passer à l’essentiel. Le numéro atomique d’un élément, également appelé numéro de proton, vous indique le nombre de protons ou de particules positives dans un atome. Un atome normal a une charge neutre avec un nombre égal de particules positives et négatives. Cela signifie qu’un atome avec une charge neutre est celui où le nombre d’électrons est égal au numéro atomique. Les ions sont des atomes avec des électrons supplémentaires ou des électrons manquants. Lorsqu’il vous manque un électron ou deux, vous avez une charge positive. Lorsque vous avez un électron ou deux supplémentaires, vous avez une charge négative.
Nous avons déjà parlé d’ions. Il est maintenant temps de passer à l’essentiel. Le numéro atomique d’un élément, également appelé numéro de proton, vous indique le nombre de protons ou de particules positives dans un atome. Un atome normal a une charge neutre avec un nombre égal de particules positives et négatives. Cela signifie qu’un atome avec une charge neutre est celui où le nombre d’électrons est égal au numéro atomique. Les ions sont des atomes avec des électrons supplémentaires ou des électrons manquants. Lorsqu’il vous manque un électron ou deux, vous avez une charge positive. Lorsque vous avez un électron ou deux supplémentaires, vous avez une charge négative. Que faites-vous si vous êtes un atome de sodium (Na)? Vous avez onze électrons — un de trop pour avoir une coquille entière remplie. Vous devez trouver un autre élément qui vous enlèvera cet électron. Quand vous perdrez cet électron, vous aurez des obus pleins. Chaque fois qu’un atome a des coquilles pleines, nous disons qu’il est « heureux. »Regardons le chlore (Cl). Le chlore a dix-sept électrons et n’en a besoin que d’un de plus pour remplir sa troisième coquille et être « heureux. »Le chlore prendra votre électron de sodium supplémentaire et vous laissera 10 électrons à l’intérieur de deux coquilles remplies. Vous êtes maintenant un atome heureux aussi. Vous êtes également un ion et il vous manque un électron. Cet électron manquant vous donne une charge positive. Vous êtes toujours l’élément sodium, mais vous êtes maintenant un ion sodium (Na +). Vous avez un électron de moins que votre numéro atomique.
Que faites-vous si vous êtes un atome de sodium (Na)? Vous avez onze électrons — un de trop pour avoir une coquille entière remplie. Vous devez trouver un autre élément qui vous enlèvera cet électron. Quand vous perdrez cet électron, vous aurez des obus pleins. Chaque fois qu’un atome a des coquilles pleines, nous disons qu’il est « heureux. »Regardons le chlore (Cl). Le chlore a dix-sept électrons et n’en a besoin que d’un de plus pour remplir sa troisième coquille et être « heureux. »Le chlore prendra votre électron de sodium supplémentaire et vous laissera 10 électrons à l’intérieur de deux coquilles remplies. Vous êtes maintenant un atome heureux aussi. Vous êtes également un ion et il vous manque un électron. Cet électron manquant vous donne une charge positive. Vous êtes toujours l’élément sodium, mais vous êtes maintenant un ion sodium (Na +). Vous avez un électron de moins que votre numéro atomique. 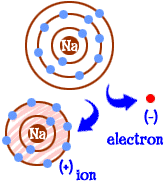 Alors maintenant vous êtes devenu un ion sodium. Vous avez dix électrons. C’est le même nombre d’électrons que le néon (Ne). Mais tu n’es pas néon. Puisqu’il vous manque un électron, vous n’êtes pas vraiment un atome de sodium complet non plus. En tant qu’ion, vous êtes maintenant quelque chose de complètement nouveau. Votre objectif en tant qu’atome était de devenir un « atome heureux » avec des coquilles d’électrons complètement remplies. Maintenant, vous avez ces coquilles remplies. Vous avez moins d’énergie. Vous avez perdu un électron et vous êtes « heureux. »Alors, qu’est-ce qui vous rend intéressant pour les autres atomes? Maintenant que vous avez abandonné l’électron, vous êtes assez attrayant électriquement. D’autres atomes chargés électriquement (ions) de la charge opposée (négative) vous regardent maintenant et voient un bon partenaire avec lequel se lier. C’est là que le chlore entre en jeu. Ce n’est pas seulement du chlore. Presque tous les ions avec une charge négative seront intéressés à se lier avec vous.
Alors maintenant vous êtes devenu un ion sodium. Vous avez dix électrons. C’est le même nombre d’électrons que le néon (Ne). Mais tu n’es pas néon. Puisqu’il vous manque un électron, vous n’êtes pas vraiment un atome de sodium complet non plus. En tant qu’ion, vous êtes maintenant quelque chose de complètement nouveau. Votre objectif en tant qu’atome était de devenir un « atome heureux » avec des coquilles d’électrons complètement remplies. Maintenant, vous avez ces coquilles remplies. Vous avez moins d’énergie. Vous avez perdu un électron et vous êtes « heureux. »Alors, qu’est-ce qui vous rend intéressant pour les autres atomes? Maintenant que vous avez abandonné l’électron, vous êtes assez attrayant électriquement. D’autres atomes chargés électriquement (ions) de la charge opposée (négative) vous regardent maintenant et voient un bon partenaire avec lequel se lier. C’est là que le chlore entre en jeu. Ce n’est pas seulement du chlore. Presque tous les ions avec une charge négative seront intéressés à se lier avec vous.
Électrovalence
Ne vous inquiétez pas du grand mot. L’électrovalence est juste un autre mot pour quelque chose qui a abandonné ou pris des électrons et est devenu un ion. Si vous regardez le tableau périodique, vous remarquerez peut-être que les éléments du côté gauche deviennent généralement des ions chargés positivement (cations) et que les éléments du côté droit reçoivent une charge négative (anions). Cette tendance signifie que le côté gauche a une valence positive et le côté droit une valence négative. La valence est une mesure de combien un atome veut se lier à d’autres atomes. C’est aussi une mesure du nombre d’électrons excités par la liaison avec d’autres atomes.
Il existe deux principaux types de liaisons, covalentes et électrovalentes. Vous avez peut-être entendu parler du terme « liaisons ioniques. »Les liaisons ioniques sont des liaisons électrovalentes. Ce ne sont que des groupes d’ions chargés maintenus ensemble par des forces électriques. Les scientifiques appellent ces groupes « agglomérats ioniques. »En présence d’autres ions, les liaisons électrovalentes sont plus faibles en raison des forces et des attractions électriques extérieures. Les ions sodium et chlore seuls ont une liaison très forte, mais dès que vous mettez ces ions dans une solution avec des ions H +, OH-, F- ou Mg ++, il y a des distractions chargées qui brisent la liaison Na-Cl.
Regardez le chlorure de sodium (NaCl) une fois de plus. Le sel est un lien très fort lorsqu’il est assis sur votre table. Il serait presque impossible de rompre ces liaisons ioniques / électrovalentes. Cependant, si vous mettez ce sel dans de l’eau (H2O), les liens se brisent très rapidement. Cela se produit facilement à cause de l’attraction électrique de l’eau. Maintenant, vous avez des ions sodium (Na +) et chlore (Cl-) flottant autour de la solution. Vous devez vous rappeler que les liaisons ioniques sont normalement fortes, mais elles sont très faibles dans l’eau.
Vidéo connexe…
Wikipedia: Ions
Encyclopedia.com : Ions