 Hemos hablado de iones antes. Ahora es el momento de ir a lo básico. El número atómico de un elemento, también llamado número de protones, indica el número de protones o partículas positivas en un átomo. Un átomo normal tiene una carga neutra con el mismo número de partículas positivas y negativas. Eso significa que un átomo con carga neutra es aquel en el que el número de electrones es igual al número atómico. Los iones son átomos con electrones adicionales o electrones faltantes. Cuando te faltan un electrón o dos, tienes una carga positiva. Cuando tienes un electrón extra o dos, tienes una carga negativa.
Hemos hablado de iones antes. Ahora es el momento de ir a lo básico. El número atómico de un elemento, también llamado número de protones, indica el número de protones o partículas positivas en un átomo. Un átomo normal tiene una carga neutra con el mismo número de partículas positivas y negativas. Eso significa que un átomo con carga neutra es aquel en el que el número de electrones es igual al número atómico. Los iones son átomos con electrones adicionales o electrones faltantes. Cuando te faltan un electrón o dos, tienes una carga positiva. Cuando tienes un electrón extra o dos, tienes una carga negativa.
 ¿Qué haces si eres un átomo de sodio (Na)? Tienes once electrones, uno de más para tener una capa completa llena. Necesitas encontrar otro elemento que te quite ese electrón. Cuando pierdas ese electrón, tendrás proyectiles llenos. Cada vez que un átomo tiene cáscaras llenas, decimos que es » feliz.»Veamos el cloro (Cl). El cloro tiene diecisiete electrones y solo necesita uno más para llenar su tercera capa y ser «feliz».»El cloro se llevará tu electrón de sodio extra y te dejará con 10 electrones dentro de dos caparazones llenos. Ahora también eres un átomo feliz. También eres un ion y te falta un electrón. Ese electrón que falta te da una carga positiva. Todavía eres el elemento sodio, pero ahora eres un ion sodio (Na+). Tienes un electrón menos que tu número atómico.
¿Qué haces si eres un átomo de sodio (Na)? Tienes once electrones, uno de más para tener una capa completa llena. Necesitas encontrar otro elemento que te quite ese electrón. Cuando pierdas ese electrón, tendrás proyectiles llenos. Cada vez que un átomo tiene cáscaras llenas, decimos que es » feliz.»Veamos el cloro (Cl). El cloro tiene diecisiete electrones y solo necesita uno más para llenar su tercera capa y ser «feliz».»El cloro se llevará tu electrón de sodio extra y te dejará con 10 electrones dentro de dos caparazones llenos. Ahora también eres un átomo feliz. También eres un ion y te falta un electrón. Ese electrón que falta te da una carga positiva. Todavía eres el elemento sodio, pero ahora eres un ion sodio (Na+). Tienes un electrón menos que tu número atómico.
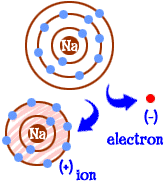 Así que ahora te has convertido en un ion de sodio. Tienes diez electrones. Es el mismo número de electrones que el neón (Ne). Pero no eres neón. Como te falta un electrón, tampoco eres un átomo de sodio completo. Como un ion, ahora eres algo completamente nuevo. Tu objetivo como átomo era convertirte en un» átomo feliz » con caparazones de electrones completamente llenos. Ahora tienes esas conchas llenas. Tienes menos energía. Perdiste un electrón y estás «feliz».»Entonces, ¿qué te hace interesante para otros átomos? Ahora que has dejado el electrón, eres bastante atractivo eléctricamente. Otros átomos cargados eléctricamente (iones) de la carga opuesta (negativa) ahora te están mirando y están viendo un buen compañero con el que vincularse. Ahí es donde entra el cloro. No es sólo cloro. Casi cualquier ion con carga negativa estará interesado en unirse con usted.
Así que ahora te has convertido en un ion de sodio. Tienes diez electrones. Es el mismo número de electrones que el neón (Ne). Pero no eres neón. Como te falta un electrón, tampoco eres un átomo de sodio completo. Como un ion, ahora eres algo completamente nuevo. Tu objetivo como átomo era convertirte en un» átomo feliz » con caparazones de electrones completamente llenos. Ahora tienes esas conchas llenas. Tienes menos energía. Perdiste un electrón y estás «feliz».»Entonces, ¿qué te hace interesante para otros átomos? Ahora que has dejado el electrón, eres bastante atractivo eléctricamente. Otros átomos cargados eléctricamente (iones) de la carga opuesta (negativa) ahora te están mirando y están viendo un buen compañero con el que vincularse. Ahí es donde entra el cloro. No es sólo cloro. Casi cualquier ion con carga negativa estará interesado en unirse con usted.
Electrovalencia
No te preocupes por la gran palabra. Electrovalencia es solo otra palabra para algo que ha abandonado o tomado electrones y se ha convertido en un ion. Si observa la tabla periódica, puede notar que los elementos del lado izquierdo generalmente se convierten en iones cargados positivamente (cationes) y los elementos del lado derecho obtienen una carga negativa (aniones). Esta tendencia significa que el lado izquierdo tiene una valencia positiva y el lado derecho tiene una valencia negativa. La valencia es una medida de cuánto quiere un átomo unirse con otros átomos. También es una medida de cuántos electrones se excitan al unirse con otros átomos.

Hay dos tipos principales de enlaces, covalentes y electrovalentes. Es posible que haya oído hablar del término «enlaces iónicos».»Los enlaces iónicos son enlaces electrovalentes. Son solo grupos de iones cargados que se mantienen unidos por fuerzas eléctricas. Los científicos llaman a estos grupos «aglomerados iónicos.»Cuando están en presencia de otros iones, los enlaces electrovalentes son más débiles debido a las fuerzas y atracciones eléctricas externas. Los iones de sodio y cloro por sí solos tienen un enlace muy fuerte, pero tan pronto como pones esos iones en una solución con iones H+, OH-, F o Mg++, hay distracciones cargadas que rompen el enlace Na – Cl.

Observe el cloruro de sodio (NaCl) una vez más. La sal es una unión muy fuerte cuando está sentada en su mesa. Sería casi imposible romper esos enlaces iónicos / electrovalentes. Sin embargo, si pones esa sal en un poco de agua (H2O), los enlaces se rompen muy rápidamente. Sucede fácilmente debido a la atracción eléctrica del agua. Ahora tiene iones de sodio (Na+) y cloro (Cl-) flotando alrededor de la solución. Debe recordar que los enlaces iónicos son normalmente fuertes, pero son muy débiles en el agua.
Vídeo relacionado…
Wikipedia: Iones
Encyclopedia.com: Iones