 we hebben het eerder over ionen gehad. Nu is het tijd om naar de basis te gaan. Het atoomnummer van een element, ook wel een protongetal genoemd, vertelt je het aantal protonen of positieve deeltjes in een atoom. Een normaal atoom heeft een neutrale lading met gelijke aantallen positieve en negatieve deeltjes. Dat betekent dat een atoom met een neutrale lading er een is waarbij het aantal elektronen gelijk is aan het atoomnummer. Ionen zijn atomen met extra elektronen of ontbrekende elektronen. Als je een elektron of twee mist, heb je een positieve lading. Als je een extra elektron of twee hebt, heb je een negatieve lading.
we hebben het eerder over ionen gehad. Nu is het tijd om naar de basis te gaan. Het atoomnummer van een element, ook wel een protongetal genoemd, vertelt je het aantal protonen of positieve deeltjes in een atoom. Een normaal atoom heeft een neutrale lading met gelijke aantallen positieve en negatieve deeltjes. Dat betekent dat een atoom met een neutrale lading er een is waarbij het aantal elektronen gelijk is aan het atoomnummer. Ionen zijn atomen met extra elektronen of ontbrekende elektronen. Als je een elektron of twee mist, heb je een positieve lading. Als je een extra elektron of twee hebt, heb je een negatieve lading. wat doe je als je een natrium (Na) atoom bent? Je hebt Elf elektronen — één te veel om een hele schaal gevuld te hebben. Je moet een ander element vinden dat dat elektron van je wegneemt. Als je dat elektron verliest, heb je volle schalen. Wanneer een atoom volledige schelpen heeft, zeggen we dat het ” gelukkig is.”Laten we eens kijken naar chloor (Cl). Chloor heeft zeventien elektronen en heeft er nog maar één nodig om zijn derde schil te vullen en “gelukkig” te zijn.”Chloor zal je extra natrium elektron nemen en je achterlaten met 10 elektronen in twee gevulde schalen. Jij bent nu ook een gelukkig atoom. Je bent ook een ion en mist één elektron. Dat ontbrekende elektron geeft je een positieve lading. Je bent nog steeds het element natrium, maar je bent nu een natriumion (Na+). Je hebt een elektron minder dan je atoomnummer.
wat doe je als je een natrium (Na) atoom bent? Je hebt Elf elektronen — één te veel om een hele schaal gevuld te hebben. Je moet een ander element vinden dat dat elektron van je wegneemt. Als je dat elektron verliest, heb je volle schalen. Wanneer een atoom volledige schelpen heeft, zeggen we dat het ” gelukkig is.”Laten we eens kijken naar chloor (Cl). Chloor heeft zeventien elektronen en heeft er nog maar één nodig om zijn derde schil te vullen en “gelukkig” te zijn.”Chloor zal je extra natrium elektron nemen en je achterlaten met 10 elektronen in twee gevulde schalen. Jij bent nu ook een gelukkig atoom. Je bent ook een ion en mist één elektron. Dat ontbrekende elektron geeft je een positieve lading. Je bent nog steeds het element natrium, maar je bent nu een natriumion (Na+). Je hebt een elektron minder dan je atoomnummer. 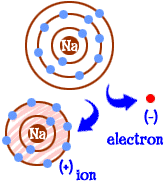 dus nu ben je een natriumion geworden. Je hebt tien elektronen. Dat is hetzelfde aantal elektronen als neon (Ne). Maar je bent geen neon. Omdat je een elektron mist, ben je ook geen compleet natriumatoom. Als ion ben je nu iets totaal nieuws. Je hele doel als atoom was om een “gelukkig atoom” te worden met volledig gevulde elektronenschillen. Nu heb je van die gevulde schelpen. Je hebt een lagere energie. Je verloor een elektron en je bent “gelukkig.”Dus wat maakt je interessant voor andere atomen? Nu je het elektron hebt opgegeven, ben je behoorlijk elektrisch aantrekkelijk. Andere elektrisch geladen atomen (ionen) van de tegengestelde lading (negatief) kijken nu naar je en zien een goede partner om mee te binden. Daar komt de chloor bij kijken. Het is niet alleen chloor. Bijna elk ion met een negatieve lading zal geïnteresseerd zijn in binding met jou.
dus nu ben je een natriumion geworden. Je hebt tien elektronen. Dat is hetzelfde aantal elektronen als neon (Ne). Maar je bent geen neon. Omdat je een elektron mist, ben je ook geen compleet natriumatoom. Als ion ben je nu iets totaal nieuws. Je hele doel als atoom was om een “gelukkig atoom” te worden met volledig gevulde elektronenschillen. Nu heb je van die gevulde schelpen. Je hebt een lagere energie. Je verloor een elektron en je bent “gelukkig.”Dus wat maakt je interessant voor andere atomen? Nu je het elektron hebt opgegeven, ben je behoorlijk elektrisch aantrekkelijk. Andere elektrisch geladen atomen (ionen) van de tegengestelde lading (negatief) kijken nu naar je en zien een goede partner om mee te binden. Daar komt de chloor bij kijken. Het is niet alleen chloor. Bijna elk ion met een negatieve lading zal geïnteresseerd zijn in binding met jou.
Electrovalentie
maak je geen zorgen over het grote woord. Elektrovalentie is gewoon een ander woord voor iets dat elektronen heeft opgegeven of genomen en een ion is geworden. Als je naar het periodiek systeem kijkt, zou je kunnen opmerken dat elementen aan de linkerkant meestal positief geladen ionen (kationen) worden en elementen aan de rechterkant een negatieve lading (anionen) krijgen. Die trend betekent dat de linkerkant een positieve valentie heeft en de rechterkant een negatieve valentie. Valentie is een maat voor de mate waarin een atoom zich wil binden met andere atomen. Het is ook een maat voor hoeveel elektronen opgewonden zijn over binding met andere atomen.
er zijn twee hoofdtypen van binding, covalente en elektrovalente. Je hebt misschien gehoord van de term “ionenbindingen.”Ionische bindingen zijn elektrovalente bindingen. Het zijn slechts groepen geladen ionen die door elektrische krachten bij elkaar worden gehouden. Wetenschappers noemen deze groepen “Ionische agglomeraten.”Wanneer in de aanwezigheid van andere ionen, zijn de elektrovalente bindingen zwakker vanwege externe elektrische krachten en aantrekkingen. Natrium-en chloorionen alleen hebben een zeer sterke binding, maar zodra je die ionen in een oplossing met H+, OH-, F – of Mg++ – ionen zet, zijn er geladen afleidingen die de Na-Cl-binding breken.
kijk nog eens naar natriumchloride (NaCl). Zout is een zeer sterke binding wanneer het op uw tafel zit. Het zou bijna onmogelijk zijn om die Ionische/elektrovalente bindingen te breken. Echter, als je dat zout in wat water doet (H2O), breken de bindingen heel snel. Het gebeurt gemakkelijk door de elektrische aantrekking van het water. Nu heb je natrium (Na+) en chloor (Cl-) ionen die rond de oplossing drijven. Je moet niet vergeten dat ionenbindingen normaal sterk zijn, maar ze zijn erg zwak in water.
gerelateerde Video…
Wikipedia: Ions
Encyclopedia.com: ionen