 am mai vorbit despre ioni înainte. Acum este timpul să trecem la elementele de bază. Numărul atomic al unui element, numit și număr de protoni, vă spune numărul de protoni sau particule pozitive dintr-un atom. Un atom normal are o sarcină neutră cu un număr egal de particule pozitive și negative. Asta înseamnă că un atom cu o sarcină neutră este unul în care numărul de electroni este egal cu numărul atomic. Ionii sunt atomi cu electroni suplimentari sau electroni lipsă. Când îți lipsește un electron sau doi, ai o sarcină pozitivă. Când aveți un electron suplimentar sau doi, aveți o sarcină negativă.
am mai vorbit despre ioni înainte. Acum este timpul să trecem la elementele de bază. Numărul atomic al unui element, numit și număr de protoni, vă spune numărul de protoni sau particule pozitive dintr-un atom. Un atom normal are o sarcină neutră cu un număr egal de particule pozitive și negative. Asta înseamnă că un atom cu o sarcină neutră este unul în care numărul de electroni este egal cu numărul atomic. Ionii sunt atomi cu electroni suplimentari sau electroni lipsă. Când îți lipsește un electron sau doi, ai o sarcină pozitivă. Când aveți un electron suplimentar sau doi, aveți o sarcină negativă. ce faci dacă ești un atom de sodiu (Na)? Aveți unsprezece electroni — unul prea mulți pentru a avea o întreagă coajă umplută. Trebuie să găsiți un alt element care să vă îndepărteze acel electron. Când pierzi acel electron, vei avea cochilii pline. Ori de câte ori un atom are cochilii pline, spunem că este „fericit.”Să ne uităm la clor (Cl). Clorul are șaptesprezece electroni și are nevoie doar de încă unul pentru a-și umple a treia coajă și a fi „fericit”.”Clorul vă va lua electronul suplimentar de sodiu și vă va lăsa cu 10 electroni în interiorul a două cochilii umplute. Acum ești și tu un atom fericit. Sunteți, de asemenea, un ion și lipsește un electron. Acest electron lipsă vă oferă o sarcină pozitivă. Sunteți încă elementul sodiu, dar acum sunteți un ion de sodiu (Na+). Ai un electron mai puțin decât numărul tău atomic.
ce faci dacă ești un atom de sodiu (Na)? Aveți unsprezece electroni — unul prea mulți pentru a avea o întreagă coajă umplută. Trebuie să găsiți un alt element care să vă îndepărteze acel electron. Când pierzi acel electron, vei avea cochilii pline. Ori de câte ori un atom are cochilii pline, spunem că este „fericit.”Să ne uităm la clor (Cl). Clorul are șaptesprezece electroni și are nevoie doar de încă unul pentru a-și umple a treia coajă și a fi „fericit”.”Clorul vă va lua electronul suplimentar de sodiu și vă va lăsa cu 10 electroni în interiorul a două cochilii umplute. Acum ești și tu un atom fericit. Sunteți, de asemenea, un ion și lipsește un electron. Acest electron lipsă vă oferă o sarcină pozitivă. Sunteți încă elementul sodiu, dar acum sunteți un ion de sodiu (Na+). Ai un electron mai puțin decât numărul tău atomic. 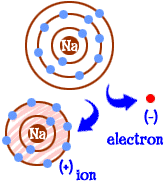 Deci acum ai devenit un ion de sodiu. Ai zece electroni. Acesta este același număr de electroni ca neonul (Ne). Dar tu nu ești neon. Din moment ce îți lipsește un electron, nu ești nici un atom de sodiu complet. Ca ion ești acum ceva complet nou. Întregul tău obiectiv ca atom a fost să devii un „atom fericit” cu cochilii de electroni complet umplute. Acum aveți acele cochilii umplute. Ai o energie mai mică. Ai pierdut un electron și ești „fericit”.”Deci, ce te face interesant pentru alți atomi? Acum că ați renunțat la electron, sunteți destul de atrăgători din punct de vedere electric. Alți atomi încărcați electric (ioni) cu sarcină opusă (negativă) se uită acum la tine și văd un partener bun cu care să te conectezi. Aici intervine clorul. Nu este doar clor. Aproape orice ion cu sarcină negativă va fi interesat să se conecteze cu dvs.
Deci acum ai devenit un ion de sodiu. Ai zece electroni. Acesta este același număr de electroni ca neonul (Ne). Dar tu nu ești neon. Din moment ce îți lipsește un electron, nu ești nici un atom de sodiu complet. Ca ion ești acum ceva complet nou. Întregul tău obiectiv ca atom a fost să devii un „atom fericit” cu cochilii de electroni complet umplute. Acum aveți acele cochilii umplute. Ai o energie mai mică. Ai pierdut un electron și ești „fericit”.”Deci, ce te face interesant pentru alți atomi? Acum că ați renunțat la electron, sunteți destul de atrăgători din punct de vedere electric. Alți atomi încărcați electric (ioni) cu sarcină opusă (negativă) se uită acum la tine și văd un partener bun cu care să te conectezi. Aici intervine clorul. Nu este doar clor. Aproape orice ion cu sarcină negativă va fi interesat să se conecteze cu dvs.
Electrovalență
nu vă faceți griji cu privire la cuvântul mare. Electrovalența este doar un alt cuvânt pentru ceva care a renunțat sau a luat electroni și a devenit un ion. Dacă te uiți la tabelul periodic, s-ar putea să observi că elementele din partea stângă devin de obicei ioni încărcați pozitiv (cationi), iar elementele din partea dreaptă primesc o sarcină negativă (anioni). Această tendință înseamnă că partea stângă are o valență pozitivă, iar partea dreaptă are o valență negativă. Valența este o măsură a cât de mult un atom dorește să se lege cu alți atomi. Este, de asemenea, o măsură a numărului de electroni care sunt entuziasmați de legătura cu alți atomi.
există două tipuri principale de legături, covalente și electrovalente. Este posibil să fi auzit de termenul „legături ionice.”Legăturile ionice sunt legături electrovalente. Sunt doar grupuri de ioni încărcați ținuți împreună de forțele electrice. Oamenii de știință numesc aceste grupuri „aglomerări ionice.”În prezența altor ioni, legăturile electrovalente sunt mai slabe din cauza forțelor și atracțiilor electrice exterioare. Ionii de sodiu și clor singuri au o legătură foarte puternică, dar de îndată ce puneți acei ioni într-o soluție cu ioni H+, OH -, F-sau Mg++, există distrageri încărcate care rup legătura Na-Cl.
Uită-te la clorura de sodiu (NaCl) încă o dată. Sarea este o legătură foarte puternică atunci când stă pe masa ta. Ar fi aproape imposibil să rupem acele legături ionice/electrovalente. Cu toate acestea, dacă puneți acea sare în puțină apă (H2O), legăturile se rup foarte repede. Se întâmplă cu ușurință din cauza atracției electrice a apei. Acum aveți ioni de sodiu (Na+) și clor (Cl-) care plutesc în jurul soluției. Trebuie să vă amintiți că legăturile ionice sunt în mod normal puternice, dar sunt foarte slabe în apă.
video legate…
Wikipedia: ionii
Encyclopedia.com: ioni