 już wcześniej mówiliśmy o jonach. Teraz czas przejść do podstaw. Liczba atomowa pierwiastka, zwana także liczbą protonów, określa liczbę protonów lub dodatnich cząstek w atomie. Normalny atom ma ładunek neutralny o równej liczbie cząstek dodatnich i ujemnych. Oznacza to, że atom z ładunkiem neutralnym jest taki, w którym liczba elektronów jest równa liczbie atomowej. Jony są atomami z dodatkowymi elektronami lub brakującymi elektronami. Kiedy brakuje elektronu lub dwóch, mamy ładunek dodatni. Kiedy masz dodatkowy elektron lub dwa, masz ładunek ujemny.
już wcześniej mówiliśmy o jonach. Teraz czas przejść do podstaw. Liczba atomowa pierwiastka, zwana także liczbą protonów, określa liczbę protonów lub dodatnich cząstek w atomie. Normalny atom ma ładunek neutralny o równej liczbie cząstek dodatnich i ujemnych. Oznacza to, że atom z ładunkiem neutralnym jest taki, w którym liczba elektronów jest równa liczbie atomowej. Jony są atomami z dodatkowymi elektronami lub brakującymi elektronami. Kiedy brakuje elektronu lub dwóch, mamy ładunek dodatni. Kiedy masz dodatkowy elektron lub dwa, masz ładunek ujemny. co zrobić, gdy jest się atomem sodu (Na)? Mamy jedenaście elektronów — o jeden za dużo, żeby cała powłoka była wypełniona. Musisz znaleźć inny pierwiastek, który odbierze ci elektron. Kiedy stracisz ten elektron, będziesz miał pełne pociski. Kiedy atom ma pełne powłoki, mówimy, że jest ” szczęśliwy.”Spójrzmy na chlor (Cl). Chlor ma siedemnaście elektronów i potrzebuje tylko jednego więcej, aby wypełnić trzecią powłokę i być ” szczęśliwym.”Chlor zabierze dodatkowy elektron sodu i pozostawi 10 elektronów wewnątrz dwóch wypełnionych powłok. Teraz też jesteś szczęśliwym atomem. Jesteś również Jonem i brakuje jednego elektronu. Brakujący elektron daje ładunek dodatni. Nadal jesteś pierwiastkiem sodowym, ale teraz jesteś Jonem sodowym (Na+). Masz jeden elektron mniej niż Twoja liczba atomowa.
co zrobić, gdy jest się atomem sodu (Na)? Mamy jedenaście elektronów — o jeden za dużo, żeby cała powłoka była wypełniona. Musisz znaleźć inny pierwiastek, który odbierze ci elektron. Kiedy stracisz ten elektron, będziesz miał pełne pociski. Kiedy atom ma pełne powłoki, mówimy, że jest ” szczęśliwy.”Spójrzmy na chlor (Cl). Chlor ma siedemnaście elektronów i potrzebuje tylko jednego więcej, aby wypełnić trzecią powłokę i być ” szczęśliwym.”Chlor zabierze dodatkowy elektron sodu i pozostawi 10 elektronów wewnątrz dwóch wypełnionych powłok. Teraz też jesteś szczęśliwym atomem. Jesteś również Jonem i brakuje jednego elektronu. Brakujący elektron daje ładunek dodatni. Nadal jesteś pierwiastkiem sodowym, ale teraz jesteś Jonem sodowym (Na+). Masz jeden elektron mniej niż Twoja liczba atomowa. 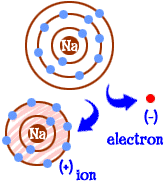 więc teraz stałeś się Jonem sodu. Masz dziesięć elektronów. To taka sama liczba elektronów jak neon (Ne). Ale ty nie jesteś neonem. Ponieważ brakuje Ci elektronu, nie jesteś kompletnym atomem sodu. Jako Jon jesteś teraz czymś zupełnie nowym. Twoim celem jako atomu było stać się „szczęśliwym atomem” z całkowicie wypełnionymi powłokami elektronowymi. Teraz masz te wypełnione pociski. Masz mniejszą energię. Straciłeś elektron i jesteś ” szczęśliwy.”Co więc czyni Cię interesującym dla innych atomów? Teraz, gdy zrezygnowaliście z elektronu, jesteście dość elektrycznie atrakcyjni. Inne naładowane elektrycznie Atomy (jony) o przeciwnym ładunku (ujemnym) patrzą teraz na Ciebie i widzą dobrego partnera do wiązania. Tam właśnie wchodzi chlor. To nie tylko chlor. Prawie każdy Jon z ujemnym ładunkiem będzie zainteresowany związaniem się z Tobą.
więc teraz stałeś się Jonem sodu. Masz dziesięć elektronów. To taka sama liczba elektronów jak neon (Ne). Ale ty nie jesteś neonem. Ponieważ brakuje Ci elektronu, nie jesteś kompletnym atomem sodu. Jako Jon jesteś teraz czymś zupełnie nowym. Twoim celem jako atomu było stać się „szczęśliwym atomem” z całkowicie wypełnionymi powłokami elektronowymi. Teraz masz te wypełnione pociski. Masz mniejszą energię. Straciłeś elektron i jesteś ” szczęśliwy.”Co więc czyni Cię interesującym dla innych atomów? Teraz, gdy zrezygnowaliście z elektronu, jesteście dość elektrycznie atrakcyjni. Inne naładowane elektrycznie Atomy (jony) o przeciwnym ładunku (ujemnym) patrzą teraz na Ciebie i widzą dobrego partnera do wiązania. Tam właśnie wchodzi chlor. To nie tylko chlor. Prawie każdy Jon z ujemnym ładunkiem będzie zainteresowany związaniem się z Tobą.
nie przejmuj się wielkim słowem. Elektrozawór to kolejne słowo na coś, co porzuciło lub pochłonęło elektrony i stało się Jonem. Jeśli spojrzysz na układ okresowy, możesz zauważyć, że pierwiastki po lewej stronie zwykle stają się dodatnio naładowanymi jonami (kationami), a pierwiastki po prawej stronie otrzymują ładunek ujemny (aniony). Trend ten oznacza, że lewa strona ma wartość dodatnią, a prawa ma wartość ujemną. Walencja jest miarą tego, jak bardzo atom chce wiązać się z innymi atomami. Jest również miarą tego, jak wiele elektronów jest podekscytowanych wiązaniem z innymi atomami.
istnieją dwa główne rodzaje wiązań, kowalencyjne i elektrozaworowe. Być może słyszałeś o pojęciu ” wiązania jonowe.”Wiązania jonowe są wiązaniami elektrozaworowymi. Są to tylko grupy naładowanych jonów utrzymywanych razem przez siły elektryczne. Naukowcy nazywają te grupy ” jonowymi aglomeratami.”W obecności innych jonów wiązania elektrozaworu są słabsze z powodu zewnętrznych sił elektrycznych i atrakcji. Same jony sodu i chloru mają bardzo silne wiązanie, ale gdy tylko umieścisz te jony w roztworze z jonami H+, OH-, F – lub Mg++, pojawiają się zakłócenia, które rozrywają Wiązanie Na-Cl.

spójrz jeszcze raz na chlorek sodu (NaCl). Sól jest bardzo silną więzią, gdy siedzi na stole. Złamanie wiązań jonowo-elektrozaworowych byłoby prawie niemożliwe. Jeśli jednak włożysz tę sól do wody (H2O), wiązania pękną bardzo szybko. Dzieje się to łatwo z powodu elektrycznego przyciągania wody. Teraz masz jony sodu (Na+) i chloru (CL-) unoszące się wokół roztworu. Należy pamiętać, że wiązania jonowe są zwykle silne, ale są bardzo słabe w wodzie.
film na temat…
Wikipedia: jony
Encyclopedia.com : jony