 vi har snakket om ioner før. Nå er det på tide å komme ned til grunnleggende. Atomnummeret til et element, også kalt et protonnummer, forteller deg antall protoner eller positive partikler i et atom. Et normalt atom har en nøytral ladning med like mange positive og negative partikler. Det betyr at et atom med en nøytral ladning er en hvor antall elektroner er lik atomnummeret. Ioner er atomer med ekstra elektroner eller manglende elektroner. Når du mangler et elektron eller to, har du en positiv ladning. Når du har en ekstra elektron eller to, har du en negativ ladning.
vi har snakket om ioner før. Nå er det på tide å komme ned til grunnleggende. Atomnummeret til et element, også kalt et protonnummer, forteller deg antall protoner eller positive partikler i et atom. Et normalt atom har en nøytral ladning med like mange positive og negative partikler. Det betyr at et atom med en nøytral ladning er en hvor antall elektroner er lik atomnummeret. Ioner er atomer med ekstra elektroner eller manglende elektroner. Når du mangler et elektron eller to, har du en positiv ladning. Når du har en ekstra elektron eller to, har du en negativ ladning.
 hva gjør du hvis du er et natrium (Na) atom? Du har elleve elektroner-en for mange til å ha et helt skall fylt. Du må finne et annet element som vil ta den elektronen bort fra deg. Når du mister den elektronen, vil du ha fulle skall. Når et atom har fulle skall, sier vi det er » lykkelig.»La oss se på klor (Cl). Klor har sytten elektroner og trenger bare en til å fylle sitt tredje skall og være » lykkelig.»Klor vil ta din ekstra natriumelektron og forlate deg med 10 elektroner inne i to fylte skall. Du er også et lykkelig atom. Du er også en ion og mangler en elektron. Den manglende elektronen gir deg en positiv ladning. Du er fortsatt grunnstoffet natrium, men du er nå et natriumion (Na+). Du har en mindre elektron enn atomnummeret ditt.
hva gjør du hvis du er et natrium (Na) atom? Du har elleve elektroner-en for mange til å ha et helt skall fylt. Du må finne et annet element som vil ta den elektronen bort fra deg. Når du mister den elektronen, vil du ha fulle skall. Når et atom har fulle skall, sier vi det er » lykkelig.»La oss se på klor (Cl). Klor har sytten elektroner og trenger bare en til å fylle sitt tredje skall og være » lykkelig.»Klor vil ta din ekstra natriumelektron og forlate deg med 10 elektroner inne i to fylte skall. Du er også et lykkelig atom. Du er også en ion og mangler en elektron. Den manglende elektronen gir deg en positiv ladning. Du er fortsatt grunnstoffet natrium, men du er nå et natriumion (Na+). Du har en mindre elektron enn atomnummeret ditt.
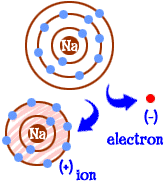 så nå har du blitt en natriumion. Du har ti elektroner. Det er samme antall elektroner som neon (Ne). Men du er ikke neon. Siden du mangler et elektron, er du egentlig ikke et komplett natriumatom heller. Som en ion er du nå noe helt nytt. Hele målet ditt som et atom var å bli et «lykkelig atom» med fullstendig fylte elektronskjell. Nå har du de fylte skjellene. Du har lavere energi. Du mistet et elektron og du er » lykkelig.»Så hva gjør deg interessant for andre atomer ? Nå som du har gitt opp elektronen, er du ganske elektrisk attraktiv. Andre elektrisk ladede atomer (ioner) av motsatt ladning (negativ) ser nå på deg og ser en god partner å knytte seg til. Det er her klor kommer inn. Det er ikke bare klor. Nesten alle ion med negativ ladning vil være interessert i å binde seg med deg.
så nå har du blitt en natriumion. Du har ti elektroner. Det er samme antall elektroner som neon (Ne). Men du er ikke neon. Siden du mangler et elektron, er du egentlig ikke et komplett natriumatom heller. Som en ion er du nå noe helt nytt. Hele målet ditt som et atom var å bli et «lykkelig atom» med fullstendig fylte elektronskjell. Nå har du de fylte skjellene. Du har lavere energi. Du mistet et elektron og du er » lykkelig.»Så hva gjør deg interessant for andre atomer ? Nå som du har gitt opp elektronen, er du ganske elektrisk attraktiv. Andre elektrisk ladede atomer (ioner) av motsatt ladning (negativ) ser nå på deg og ser en god partner å knytte seg til. Det er her klor kommer inn. Det er ikke bare klor. Nesten alle ion med negativ ladning vil være interessert i å binde seg med deg.
Electrovalence
ikke bli bekymret for det store ordet. Elektrovalens er bare et annet ord for noe som har gitt opp eller tatt elektroner og blitt en ion. Hvis du ser på det periodiske bordet, kan du legge merke til at elementer på venstre side vanligvis blir positivt ladede ioner (kationer) og elementer på høyre side får en negativ ladning (anioner). Den trenden betyr at venstre side har en positiv valens og høyre side har en negativ valens. Valens er et mål på hvor mye et atom vil binde seg med andre atomer. Det er også et mål på hvor mange elektroner er begeistret for binding med andre atomer.

det finnes to hovedtyper av binding, kovalent og elektrovalent. Du har kanskje hørt om begrepet » ioniske obligasjoner.»Ioniske bindinger er elektrovalente bindinger. De er bare grupper av ladede ioner holdt sammen av elektriske krefter. Forskere kaller disse gruppene » ioniske agglomerater.»Når i nærvær av andre ioner, er de elektrovalente bindingene svakere på grunn av eksterne elektriske krefter og attraksjoner. Natrium – og klorioner alene har en veldig sterk binding, men så snart du legger disse ionene i en løsning MED H+, OH -, F-eller Mg++ – ioner, er det ladede distraksjoner som bryter Na-Cl-bindingen.
Se på natriumklorid (nacl) en gang til. Salt er et veldig sterkt bånd når det sitter på bordet ditt. Det ville være nesten umulig å bryte de ioniske / elektrovalente bindingene. Men hvis du setter det saltet i litt vann (H2O), bryter bindingene veldig raskt. Det skjer lett på grunn av vannets elektriske tiltrekning. Nå har du natrium (Na+) og klor (Cl-) ioner som flyter rundt løsningen. Du bør huske at ioniske bindinger normalt er sterke, men de er svært svake i vann.
Relatert Video…
Encyclopediaæ
Wikipedia: Ioner
Encyclopedia.com: Ioner