 私たちは前にイオンについて話しました。 今では基本に取り掛かるための時間です。 また、陽子数と呼ばれる要素の原子番号は、あなたの原子中の陽子または正の粒子の数を示しています。 通常の原子は、正と負の粒子の数が等しい中性電荷を持っています。 つまり、中性電荷を持つ原子は、電子の数が原子番号に等しい原子であることを意味します。 イオンは、余分な電子または不足している電子を有する原子である。 あなたが電子または二つを欠いているとき、あなたは正の電荷を持っています。 あなたが余分な電子または2つを持っているとき、あなたは負の電荷を持っています。
私たちは前にイオンについて話しました。 今では基本に取り掛かるための時間です。 また、陽子数と呼ばれる要素の原子番号は、あなたの原子中の陽子または正の粒子の数を示しています。 通常の原子は、正と負の粒子の数が等しい中性電荷を持っています。 つまり、中性電荷を持つ原子は、電子の数が原子番号に等しい原子であることを意味します。 イオンは、余分な電子または不足している電子を有する原子である。 あなたが電子または二つを欠いているとき、あなたは正の電荷を持っています。 あなたが余分な電子または2つを持っているとき、あなたは負の電荷を持っています。 あなたはナトリウム(Na)原子であれば、あなたは何をしますか? あなたは11個の電子を持っています—1つはあまりにも多く、殻全体が満たされていません。 あなたはあなたからその電子を奪う別の要素を見つける必要があります。 あなたがその電子を失うと、あなたは完全な殻を持つでしょう。 原子が完全な殻を持っているときはいつでも、私たちはそれが”幸せ”であると言います。”塩素(Cl)を見てみましょう。 塩素には17個の電子があり、その3番目の殻を満たし、「幸せになるためにもう1つだけ必要です。”塩素はあなたの余分なナトリウム電子を取り、2つの充填された殻の中に10個の電子を残します。 あなたは今も幸せな原子です。 あなたはまた、イオンであり、一つの電子が欠けています。 その欠けている電子はあなたに正の電荷を与えます。 あなたはまだ要素ナトリウムですが、あなたは今ナトリウムイオン(Na+)です。 あなたはあなたの原子番号よりも少ない電子を持っています。
あなたはナトリウム(Na)原子であれば、あなたは何をしますか? あなたは11個の電子を持っています—1つはあまりにも多く、殻全体が満たされていません。 あなたはあなたからその電子を奪う別の要素を見つける必要があります。 あなたがその電子を失うと、あなたは完全な殻を持つでしょう。 原子が完全な殻を持っているときはいつでも、私たちはそれが”幸せ”であると言います。”塩素(Cl)を見てみましょう。 塩素には17個の電子があり、その3番目の殻を満たし、「幸せになるためにもう1つだけ必要です。”塩素はあなたの余分なナトリウム電子を取り、2つの充填された殻の中に10個の電子を残します。 あなたは今も幸せな原子です。 あなたはまた、イオンであり、一つの電子が欠けています。 その欠けている電子はあなたに正の電荷を与えます。 あなたはまだ要素ナトリウムですが、あなたは今ナトリウムイオン(Na+)です。 あなたはあなたの原子番号よりも少ない電子を持っています。 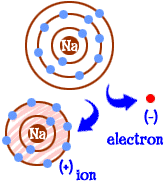 だから今、あなたはナトリウムイオンになってきました。 あなたは十個の電子を持っています。 それはネオン(Ne)と同じ数の電子です。 しかし、あなたはネオンではありません。 あなたは電子が欠けているので、あなたは本当に完全なナトリウム原子でもありません。 イオンとして、あなたは今、完全に新しいものです。 原子としてのあなたの全体の目標は、完全に満たされた電子殻を持つ”幸せな原子”になることでした。 今、あなたはそれらの満たされた殻を持っています。 あなたはより低いエネルギーを持っています。 あなたは電子を失い、あなたは”幸せです。”だから、何が他の原子に興味深いものになりますか? あなたは電子をあきらめたので、あなたは非常に電気的に魅力的です。 反対の電荷(負)の他の電気的に帯電した原子(イオン)は、今あなたを見て、と結合するための良いパートナーを見ています。 それが塩素の出番です。 それは塩素だけではありません。 負電荷を持つほとんどのイオンはあなたとの結合に興味があります。
だから今、あなたはナトリウムイオンになってきました。 あなたは十個の電子を持っています。 それはネオン(Ne)と同じ数の電子です。 しかし、あなたはネオンではありません。 あなたは電子が欠けているので、あなたは本当に完全なナトリウム原子でもありません。 イオンとして、あなたは今、完全に新しいものです。 原子としてのあなたの全体の目標は、完全に満たされた電子殻を持つ”幸せな原子”になることでした。 今、あなたはそれらの満たされた殻を持っています。 あなたはより低いエネルギーを持っています。 あなたは電子を失い、あなたは”幸せです。”だから、何が他の原子に興味深いものになりますか? あなたは電子をあきらめたので、あなたは非常に電気的に魅力的です。 反対の電荷(負)の他の電気的に帯電した原子(イオン)は、今あなたを見て、と結合するための良いパートナーを見ています。 それが塩素の出番です。 それは塩素だけではありません。 負電荷を持つほとんどのイオンはあなたとの結合に興味があります。
電気価
大きな言葉を心配しないでください。 電気価は、電子をあきらめたり取ったりしてイオンになったりしたもののための単なる別の言葉です。 周期表を見ると、左側の要素は通常正に帯電したイオン(陽イオン)になり、右側の要素は負の電荷(陰イオン)になることに気付くかもしれません。 その傾向は、左側が正の価数を持ち、右側が負の価数を持つことを意味します。 原子価は、原子が他の原子と結合したい量の尺度です。 それはまた、他の原子との結合について励起されている電子の数の尺度でもあります。
結合には、共有結合と電気価の二つの主なタイプがあります。 あなたは”イオン結合”という用語を聞いたことがあるかもしれません。”イオン結合は電気価結合である。 それらは、電気力によって一緒に保持された荷電イオンの単なるグループです。 科学者たちはこれらのグループを”イオン凝集体”と呼んでいます。「他のイオンの存在下では、電気価結合は外部の電気力と誘引力のために弱い。 ナトリウムと塩素イオンだけでは非常に強い結合を持っていますが、H+、OH-、F-またはMg++イオンを含む溶液にそれらのイオンを入れるとすぐに、Na-Cl結合を壊す帯電した気晴らしがあります。
塩化ナトリウム(NaCl)をもう一度見てください。 それはあなたのテーブルの上に座っているときに塩は非常に強い結合です。 これらのイオン/電気価結合を破ることはほぼ不可能であろう。 しかし、その塩をいくつかの水(H2O)に入れると、結合は非常に迅速に壊れます。 それは水の電気的魅力のために簡単に起こります。 今、あなたはナトリウム(Na+)と塩素(Cl-)イオンが溶液の周りに浮かんでいます。 イオン結合は通常強いが、水には非常に弱いことを覚えておく必要があります。
関連ビデオ。..
Wikipedia:イオン
Encyclopedia.com:イオン