 Abbiamo già parlato di ioni. Ora è il momento di scendere alle basi. Il numero atomico di un elemento, chiamato anche numero di protoni, indica il numero di protoni o particelle positive in un atomo. Un atomo normale ha una carica neutra con un numero uguale di particelle positive e negative. Ciò significa che un atomo con una carica neutra è uno in cui il numero di elettroni è uguale al numero atomico. Gli ioni sono atomi con elettroni extra o elettroni mancanti. Quando ti manca un elettrone o due, hai una carica positiva. Quando hai un elettrone in più o due, hai una carica negativa.
Abbiamo già parlato di ioni. Ora è il momento di scendere alle basi. Il numero atomico di un elemento, chiamato anche numero di protoni, indica il numero di protoni o particelle positive in un atomo. Un atomo normale ha una carica neutra con un numero uguale di particelle positive e negative. Ciò significa che un atomo con una carica neutra è uno in cui il numero di elettroni è uguale al numero atomico. Gli ioni sono atomi con elettroni extra o elettroni mancanti. Quando ti manca un elettrone o due, hai una carica positiva. Quando hai un elettrone in più o due, hai una carica negativa.
 Cosa fai se sei un atomo di sodio (Na)? Hai undici elettroni-uno di troppo per avere un intero guscio pieno. Devi trovare un altro elemento che ti porterà via quell’elettrone. Quando si perde quell’elettrone, si avrà gusci pieni. Ogni volta che un atomo ha gusci pieni, diciamo che è ” felice.”Diamo un’occhiata al cloro (Cl). Cloro ha diciassette elettroni e solo bisogno di un altro per riempire il suo terzo guscio ed essere “felice.”Il cloro prenderà il tuo elettrone di sodio in più e ti lascerà con 10 elettroni all’interno di due gusci pieni. Ora sei anche un atomo felice. Sei anche uno ion e manca un elettrone. Quell’elettrone mancante ti dà una carica positiva. Sei ancora l’elemento sodio, ma ora sei uno sodium sodio (Na+). Hai un elettrone in meno del tuo numero atomico.
Cosa fai se sei un atomo di sodio (Na)? Hai undici elettroni-uno di troppo per avere un intero guscio pieno. Devi trovare un altro elemento che ti porterà via quell’elettrone. Quando si perde quell’elettrone, si avrà gusci pieni. Ogni volta che un atomo ha gusci pieni, diciamo che è ” felice.”Diamo un’occhiata al cloro (Cl). Cloro ha diciassette elettroni e solo bisogno di un altro per riempire il suo terzo guscio ed essere “felice.”Il cloro prenderà il tuo elettrone di sodio in più e ti lascerà con 10 elettroni all’interno di due gusci pieni. Ora sei anche un atomo felice. Sei anche uno ion e manca un elettrone. Quell’elettrone mancante ti dà una carica positiva. Sei ancora l’elemento sodio, ma ora sei uno sodium sodio (Na+). Hai un elettrone in meno del tuo numero atomico.
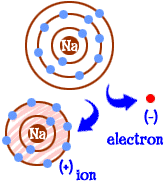 Così ora sei diventato uno sodium sodio. Hai dieci elettroni. Questo è lo stesso numero di elettroni del neon (Ne). Ma tu non sei neon. Dal momento che ti manca un elettrone, non sei nemmeno un atomo di sodio completo. Come ion sei ora qualcosa di completamente nuovo. Il tuo intero obiettivo come atomo era quello di diventare un “atomo felice” con gusci di elettroni completamente pieni. Ora hai quei gusci pieni. Hai un’energia inferiore. Hai perso un elettrone e sei ” felice.”Allora, cosa ti rende interessante per gli altri atomi? Ora che hai rinunciato all’elettrone, sei abbastanza elettricamente attraente. Altri atomi elettricamente caricati (ioni) della carica opposta (negativo) ora ti guardano e vedono un buon partner con cui legarsi. Ecco dove entra in gioco il cloro. Non è solo cloro. Quasi tutti gli ioni con una carica negativa saranno interessati a legare con te.
Così ora sei diventato uno sodium sodio. Hai dieci elettroni. Questo è lo stesso numero di elettroni del neon (Ne). Ma tu non sei neon. Dal momento che ti manca un elettrone, non sei nemmeno un atomo di sodio completo. Come ion sei ora qualcosa di completamente nuovo. Il tuo intero obiettivo come atomo era quello di diventare un “atomo felice” con gusci di elettroni completamente pieni. Ora hai quei gusci pieni. Hai un’energia inferiore. Hai perso un elettrone e sei ” felice.”Allora, cosa ti rende interessante per gli altri atomi? Ora che hai rinunciato all’elettrone, sei abbastanza elettricamente attraente. Altri atomi elettricamente caricati (ioni) della carica opposta (negativo) ora ti guardano e vedono un buon partner con cui legarsi. Ecco dove entra in gioco il cloro. Non è solo cloro. Quasi tutti gli ioni con una carica negativa saranno interessati a legare con te.
Elettrovalenza
Non preoccuparti della parola grossa. L’elettrovalenza è solo un’altra parola per qualcosa che ha rinunciato o preso elettroni e diventare uno ion. Se si guarda la tavola periodica, si potrebbe notare che gli elementi sul lato sinistro di solito diventano ioni caricati positivamente (cationi) e gli elementi sul lato destro ottengono una carica negativa (anioni). Questa tendenza significa che il lato sinistro ha una valenza positiva e il lato destro ha una valenza negativa. La valenza è una misura di quanto un atomo vuole legarsi con altri atomi. È anche una misura di quanti elettroni sono entusiasti del legame con altri atomi.

Esistono due tipi principali di legame, covalente ed elettrovalente. Potreste aver sentito parlare del termine ” legami ionici.”I legami ionici sono legami elettrovalenti. Sono solo gruppi di ioni carichi tenuti insieme da forze elettriche. Gli scienziati chiamano questi gruppi “agglomerati ionici.”Quando in presenza di altri ioni, i legami elettrovalenti sono più deboli a causa di forze elettriche esterne e attrazioni. Gli ioni sodio e cloro da soli hanno un legame molto forte, ma non appena si mettono quegli ioni in una soluzione con ioni H+, OH-, F – o Mg++, ci sono distrazioni cariche che rompono il legame Na-Cl.

Guarda ancora una volta il cloruro di sodio (NaCl). Il sale è un legame molto forte quando è seduto sul tuo tavolo. Sarebbe quasi impossibile rompere quei legami ionici / elettrovalenti. Tuttavia, se metti quel sale in acqua (H2O), i legami si rompono molto rapidamente. Succede facilmente a causa dell’attrazione elettrica dell’acqua. Ora hai ioni di sodio (Na+) e cloro (Cl-) che galleggiano intorno alla soluzione. Dovresti ricordare che i legami ionici sono normalmente forti, ma sono molto deboli in acqua.
Video correlati…
Wikipedia: Ioni
Encyclopedia.com: Ioni