Comme vous le savez, Dmitri Mendeleïev est le père du tableau périodique. Mais saviez-vous que le Tableau périodique moderne que nous utilisons a en fait été développé par un scientifique nommé Henry Moseley? Apprenons l’histoire fascinante derrière le tableau périodique.
Suggested Videos
Tableau Périodique moderne
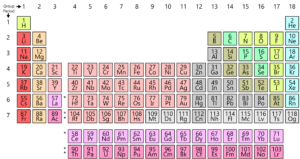
Comme vous le savez, tous les éléments trouvés sur terre sont disposés dans une grille ou une matrice appelée Tableau périodique moderne. La disposition de ces éléments est selon un motif. Le tableau périodique a été réellement développé et par Mendeleïev au début des années 1800. Cependant, il a en fait été perfectionné par Henry Moseley, un physicien anglais en 1913. En apportant des ajustements à la loi périodique, il a amélioré tous les défauts de la table de Mendeleïev. Jetons un coup d’œil à cette évolution.
Parcourez d’autres sujets sous Classification Périodique des Éléments
- Tentatives antérieures de Classification des Éléments
- Position des Éléments dans le Tableau Périodique Moderne
- Tendances dans le Tableau Périodique Moderne
En utilisant le Numéro Atomique
Tout d’abord, examinons la structure d’un atome. Chaque atome est composé d’un noyau composé de protons et de neutrons. Ici, les protons ont une charge positive et un neutron n’a pas de charge. Maintenant, des électrons (porteurs d’une charge négative) entourent le noyau. Maintenant, le nombre de masse atomique est le nombre total de protons et de neutrons dans un atome. Et le numéro atomique est le nombre de protons dans un atome. Ce numéro atomique est complètement unique à chaque élément, ce qui signifie que chaque élément de la planète a son propre numéro atomique unique.
C’est Henry Moseley qui a suggéré un meilleur arrangement que Mendeleïev. Il a arrangé les éléments en fonction de leur Numéro atomique plutôt que de leur masse atomique. Ce faisant, il améliora le tableau précédent et supprima certaines de ses difficultés et anomalies.
Position de l’hydrogène
Mendeleïev n’a jamais pu déterminer la position correcte de l’hydrogène dans son tableau. Puisque l’hydrogène peut gagner ou perdre un électron, il peut trouver une place dans le groupe 1 ou 17. Sa configuration électronique ressemble à celle des métaux alcalins. Bien qu’il puisse également se combiner avec des métaux et des non-métaux formant des liaisons covalentes comme les halogènes.
Mais dans le tableau périodique moderne, il n’y a pas de dilemme. Puisque le numéro atomique de l’hydrogène est 1, c’est là qu’il trouve sa place appropriée au début du tableau.
Isotopes
Les isotopes sont des atomes différents d’un élément dont chacun a le même nombre de protons, mais un nombre différent de neutrons dans leurs noyaux. Cela implique que bien que leur masse atomique varie, leur numéro atomique est le même. Comme par exemple, le carbone 14 est un isotope radioactif de l’atome de carbone qui contient huit neutrons.
Alors que cela posait un problème pour Mendeleïev, puisque le tableau dépendait de la masse atomique, ce n’est pas un problème avec le tableau périodique moderne. Tous les isotopes des éléments n’ont pas d’endroits séparés sur la table.
Ordre de certains éléments
Mendeleïev lors de l’utilisation de la masse atomique pour organiser des éléments a rencontré un autre problème. Il y avait certains cas où il y avait une rupture de cet arrangement de sorte que les éléments ayant des propriétés similaires étaient en groupe ensemble. Prenons l’exemple de l’iode et du tellure. Maintenant, la masse atomique de l’iode est inférieure à celle du tellure. Et pourtant, Mendeleïev l’a mis après le tellure pour qu’il puisse être dans le même groupe que le fluor et le chlore.
Dans le tableau périodique moderne, la masse atomique devient sans importance et les éléments sont regroupés avec des éléments similaires en fonction de leur numéro atomique.
Éléments de Terres rares
Le tableau périodique moderne a résolu un autre problème en plaçant les éléments de terres rares tels que le Cérium, le Lanthane, l’Erbium, etc. dans un tableau séparé au bas du tableau périodique, afin de ne pas interférer avec la Loi périodique.
Exemple résolu pour vous
Q: Sur les 118 éléments que nous connaissons, combien d’éléments se produisent naturellement?