Termes clés
Assurez-vous que vous pouvez définir et utiliser en contexte les termes clés ci-dessous.
- Catalyseur d’Adams
- hydrogénation
Notes d’étude
Les réactions chimiques hétérogènes ont des réactifs qui se trouvent dans au moins deux phases différentes (par exemple un gaz avec un solide), alors que les réactions homogènes se produisent en une seule phase (par exemple un gaz avec un autre gaz).
Une certaine confusion peut résulter de la description du catalyseur utilisé dans la réaction entre alcènes et hydrogène. Trois métaux – le nickel, le platine et le palladium — sont couramment utilisés, mais un chimiste ne peut pas simplement placer un morceau de l’un de ces métaux dans un mélange d’alcène et d’hydrogène et obtenir une réaction. Chaque catalyseur métallique doit être préparé d’une manière spéciale:
- le nickel est généralement utilisé sous une forme finement divisée appelée « nickel de Raney. »Il est préparé en faisant réagir un alliage Ni-Al avec du NaOH.
- le palladium est obtenu commercialement « supporté » sur une substance inerte, telle que le charbon de bois, (Pd/C). L’alcène est généralement dissous dans l’éthanol lorsque le Pd / C est utilisé comme catalyseur.
- le platine est utilisé comme PtO2, le catalyseur d’Adams, bien que ce soit en fait du platine métal qui en soit le catalyseur. L’hydrogène utilisé pour ajouter à la double liaison carbone-carbone réduit également l’oxyde de platine (IV) en métal de platine finement divisé. L’éthanol ou l’acide acétique est utilisé comme solvant pour l’alcène.
D’autres types de composés contenant des liaisons multiples, tels que les cétones, les esters et les nitriles, ne réagissent pas avec l’hydrogène dans les conditions utilisées pour hydrogéner les alcènes. Les exemples ci-dessous montrent une réduction d’un alcène, mais les groupements cétone et nitrile présents restent intacts et ne sont pas réduits.

Les cycles aromatiques ne sont pas non plus réduits dans les conditions utilisées pour réduire les alcènes, bien que ces cycles semblent contenir trois doubles liaisons carbone-carbone. Comme vous le verrez plus loin, les cycles aromatiques ne contiennent pas vraiment de doubles liaisons, et de nombreux chimistes préfèrent représenter le cycle benzénique comme un hexagone avec un cercle à l’intérieur

plutôt que comme un hexagone avec trois doubles liaisons alternées.
La représentation du cycle benzénique sera discutée plus en détail dans la section 15.2.
La réaction entre les doubles liaisons carbone-carbone et l’hydrogène fournit une méthode pour déterminer le nombre de doubles liaisons présentes dans un composé. Par exemple, une mole de cyclohexène réagit avec une mole d’hydrogène pour produire une mole de cyclohexane :

mais une mole de 1,4-cyclohexadiène réagit avec deux moles d’hydrogène pour former une mole de cyclohexane:
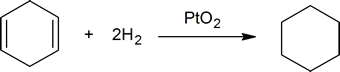
Un chimiste dirait que le cyclohexène réagit avec un équivalent d’hydrogène et le 1,4-cyclohexadiène réagit avec deux équivalents d’hydrogène. Si vous prenez une quantité connue d’un hydrocarbure insaturé inconnu et déterminez la quantité d’hydrogène qu’il absorbera, vous pouvez facilement déterminer le nombre de doubles liaisons présentes dans l’hydrocarbure (voir la question 2 ci-dessous).
L’addition d’hydrogène à une double liaison carbone-carbone est appelée hydrogénation. L’effet global d’une telle addition est l’élimination réductrice du groupe fonctionnel à double liaison. La régiosélectivité n’est pas un problème, car le même groupe (un atome d’hydrogène) est lié à chacun des carbones à double liaison. La source la plus simple de deux atomes d’hydrogène est l’hydrogène moléculaire (H2), mais le mélange d’alcènes avec de l’hydrogène n’entraîne aucune réaction perceptible. Bien que la réaction d’hydrogénation globale soit exothermique, une énergie d’activation élevée l’empêche de se produire dans des conditions normales. Cette restriction peut être contournée par l’utilisation d’un catalyseur, comme le montre le schéma suivant.
Un exemple de réaction d’addition d’alcènes est un processus appelé hydrogenation.In une réaction d’hydrogénation, deux atomes d’hydrogène sont ajoutés à travers la double liaison d’un alcène, ce qui donne un alcane saturé. L’hydrogénation d’une double liaison est une réaction thermodynamiquement favorable car elle forme un produit plus stable (à énergie plus faible). En d’autres termes, l’énergie du produit est inférieure à l’énergie du réactif ; elle est donc exothermique (de la chaleur est libérée). La chaleur dégagée est appelée chaleur d’hydrogénation, qui est un indicateur de la stabilité d’une molécule.


Les catalyseurs sont des substances qui modifient la vitesse (vitesse) d’une réaction chimique sans être consommées ni faire partie du produit. Les catalyseurs agissent en abaissant l’énergie d’activation des réactions, mais ils ne modifient pas l’énergie potentielle relative des réactifs et des produits. Les métaux finement divisés, tels que le platine, le palladium et le nickel, sont parmi les catalyseurs d’hydrogénation les plus utilisés. L’hydrogénation catalytique se déroule en au moins deux étapes, comme représenté sur le diagramme. Tout d’abord, l’alcène doit être adsorbé à la surface du catalyseur avec une partie de l’hydrogène. Ensuite, deux hydrogènes se déplacent de la surface métallique vers les carbones de la double liaison, et l’hydrocarbure saturé résultant, qui est plus faiblement adsorbé, quitte la surface du catalyseur. La nature exacte et le calendrier des derniers événements ne sont pas bien compris.

Comme le montre le diagramme d’énergie, l’hydrogénation des alcènes est exothermique et la chaleur est libérée correspondant au ΔE (de couleur verte) du diagramme. Cette chaleur de réaction peut être utilisée pour évaluer la stabilité thermodynamique d’alcènes ayant différents nombres de substituants alkyles sur la double liaison. Par example, le tableau suivant répertorie les chaleurs d’hydrogénation pour trois alcènes C5H10 qui donnent le même produit alcane (2-méthylbutane). Comme une chaleur de réaction importante indique un réactif à haute énergie, ces chaleurs sont inversement proportionnelles aux stabilités des isomères d’alcènes. En approximation approximative, nous voyons que chaque substituant alkyle sur une double liaison stabilise ce groupe fonctionnel d’un peu plus de 1 kcal/ mole.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

D’après le mécanisme montré ici, nous nous attendons à ce que l’addition d’hydrogène se produise avec une syn-stéréosélectivité. Cela est souvent vrai, mais les catalyseurs d’hydrogénation peuvent également provoquer une isomérisation de la double liaison avant l’addition d’hydrogène, auquel cas la stéréosélectivité peut être incertaine.

Exercices
- Dans la réaction
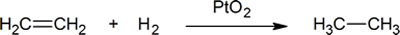
- 0,500 mole d’éthène réagit avec _______mole d’hydrogène. Ainsi, un chimiste pourrait dire que l’éthène réagit avec un _______ d’hydrogène.
- l’éthène est _______; tandis que _______ est oxydé.
- le nombre d’oxydation du carbone dans l’éthène est _______; dans l’éthane, il est _______.
- Lorsque 1.000 g d’un certain triglycéride (graisse) sont traités avec de l’hydrogène gazeux en présence du catalyseur d’Adams, on constate que le volume d’hydrogène gazeux consommé à 99,8 kPa et 25,0°C est de 162 mL. Une expérience distincte indique que la masse molaire de la graisse est de 914 g de mol−1. Combien de doubles liaisons carbone-carbone contient le composé?
Réponses:
-
-
Afficher la réponse
-
Afficher la réponse
-
Afficher la réponse
-
-
Afficher la réponse
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Université d’État de Sonoma)
- Chimie organique avec un accent biologique par Tim Soderberg (Université du Minnesota, Morris)