Au début du XIXe siècle, von Reckingausen a observé que les vaisseaux sanguins étaient recouverts d’une feuille de cellules. Cette couche épaisse d’une cellule est composée de cellules endothéliales qui tapissent la surface interne des vaisseaux sanguins et lymphatiques. Chez l’homme, on estime que la surface totale de la couche endothéliale est d’environ 35 m2 et qu’il y a environ 1 à 1,6 103 cellules endothéliales. La longueur totale des artères, des veines et des capillaires est d’environ 90000 km (plus de deux fois le tour du monde). Les cellules endothéliales sont plates et reliées entre elles par des jonctions cellulaires. Leur fonction principale est d’intermédiaires entre le sang et les autres tissus, et contribue aux propriétés du sang, à la fois dans les tissus normaux et pathologiques. Ils sont également importants pour l’échange de cellules immunitaires entre le sang et les tissus.
1. Morphologie
Les cellules endothéliales sont des cellules très aplaties, à tel point que leur noyau est la structure la plus haute de la cellule, même si le noyau est également aplati. La forme cellulaire est adaptée au canal tapissé par la cellule endothéliale (Figure 1, 2 et 3). Dans les capillaires plus étroits, les cellules endothéliales peuvent étendre leur cytoplasme sur tout le périmètre du vaisseau sanguin, de sorte que le canal est une rangée de cellules endothéliales. Dans les canaux plus grands, comme les artères et les veines, de nombreuses cellules endothéliales sont nécessaires pour couvrir le périmètre total du canal.
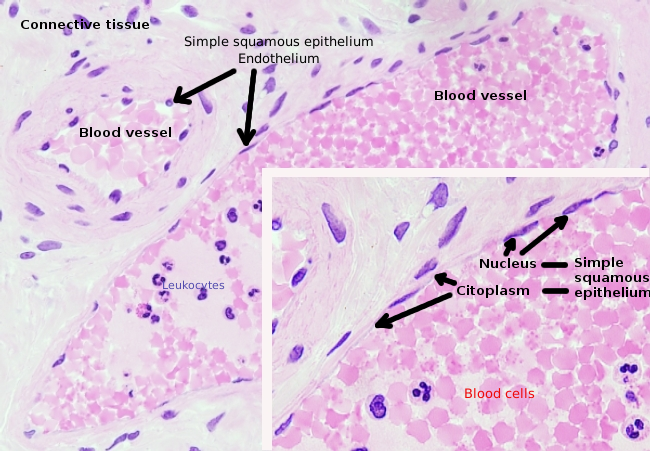
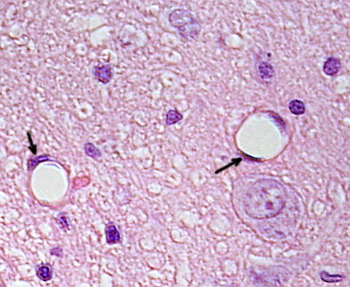
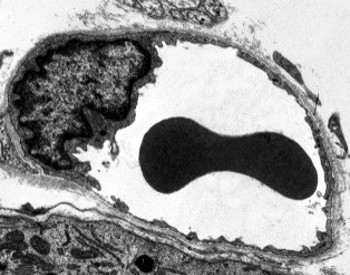
Le cytoplasme périnucléaire contient la plupart des mitochondries et d’autres organites, tels que l’appareil de Golgi, alors que le cytoplasme périphérique est plus mince et a peu d’organites, bien que le réticulum endoplasmique se trouve près de la membrane plasmique. Les cellules endothéliales ont de nombreuses vésicules, la plupart d’entre elles sont des vésicules endocytaires.
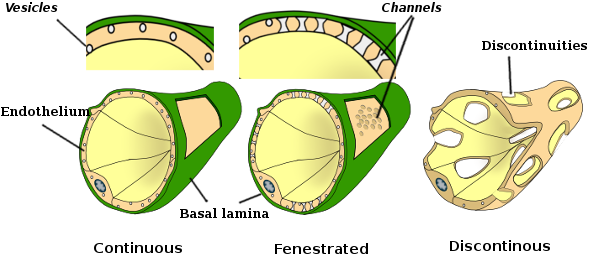
Dans certaines régions, telles que le foie, le cortex rénal et les glandes endocrines, les cellules endothéliales des capillaires présentent des pores ou de petits passages, appelés fenestratrions. Ce sont des voies d’environ 60 à 70 nm de diamètre, avec un passage étroit d’environ 5 nm, qui communiquent directement le sang et la lymphe avec les autres tissus. Les capillaires ayant ces types de cellules endothéliales sont connus sous le nom de capillaires fenestrés. Les pores sont répartis en groupes et leur densité dépend du type d’endothélium.
Les cellules endothéliales sont séparées du tissu environnant par une couche de matrice extracellulaire appelée lame basale. Les cellules endothéliales contribuent à cette couche avec les protéines laminine, fibronectine et collagène de type II, IV et V.
Source et prolifération
La vasculogenèse est la formation de nouvelles cellules endothéliales dans des tissus sans vaisseaux sanguins préexistants. Cela se produit dans l’embryon. Chez les adultes, ainsi que chez les embryons, de nouveaux vaisseaux sanguins, et donc de nouvelles cellules endothéliales, sont générés à partir de vaisseaux sanguins déjà présents. Ce processus est connu sous le nom d’angiogenèse. De nouvelles cellules endothéliales sont produites par ramification ou division des vaisseaux sanguins et lymphatiques. L’angiogenèse est fréquente dans les tissus en croissance ou ceux soumis à un remodelage important, comme l’utérus chez les femelles mammifères, ou dans des pathologies telles que les tumeurs, l’inflammation et les plaies.
Vasculogenèse
Les premières cellules endothéliales des mammifères sont générées après gastrulation pendant le développement de l’embryon. Ils se différencient des cellules appelées angioblastes, forment des groupes et s’organisent en vaisseaux sanguins courts. Ce processus se produit d’abord dans le sac de vitéline de l’embryon. Ces vaisseaux sanguins initiaux se développent et se connectent les uns aux autres pour former un réseau. Plus tard, ils recrutent des fibroblastes et des cellules musculaires. Ce réseau initial subit un processus de remodelage continu au cours des étapes de développement suivantes. Dans les embryons, toutes les cellules endothéliales sont initialement similaires, mais elles se différencient plus tard en endothélium veineux, artériel, capillaire et lymphatique. Plusieurs molécules comme FGF2, BMP4, IHH et VEGF induisent des voies de différenciation séparées. L’inducteur Notch semble être très important car il conduit à l’endothélium artériel, tandis que son inhibition conduit à l’endothélium veineux. L’endothélium lymphatique est formé à partir de l’endothélium de la veine cardinale et nécessite l’expression de COUPF-II et de SOX18. De plus, l’endothélium est différencié en fonction de l’organe dans lequel il se trouve. Par exemple, l’endothélium forme une couche hermétiquement scellée dans le cerveau pour former la barrière hémato-encéphalique, alors qu’il est fenestré de manière lâche dans le foie pour favoriser l’échange de molécules avec le sang.
Au fur et à mesure que les cellules endothéliales s’organisent dans les canaux artériels et veineux, certaines cellules endothéliales donnent naissance à des cellules hématopoïétiques par un processus de différenciation appelé transition endothéliale-hématopoïétique (T). Ce processus se produit également dans certains tissus adultes comme lors de la formation du placenta et d’autres tissus pendant la grossesse.
Angiogenèse
L’angiogenèse est la formation de nouveaux vaisseaux sanguins et d’endothélium par ramification ou division de vaisseaux sanguins préexistants. Chez l’adulte, le taux de prolifération des cellules endothéliales est très faible. Par exemple, chez les mammifères, une cellule endothéliale peut se diviser une fois par mois ou peut attendre plusieurs années. Cela signifie que l’angiogenèse est rare dans les tissus de physiologie normale, à l’exception des organes reproducteurs féminins. Cependant, il peut être activé dans des processus pathologiques tels que des lésions tissulaires et des tumeurs. Certaines substances induisent l’angiogenèse, telles que le facteur de croissance endothélial (EGF), l’EGF acide, le facteur de croissance des fibroblastes (FGF), le facteur de croissance transformant (TGF) et les prostaglandines. L’angiogenèse commence lorsque des substances angiogéniques sont libérées des tissus environnants. La cellule endothéliale d’un vaisseau sanguin proche, généralement à partir d’une veinule, commence à migrer vers la source de signal angiogénique, entraînant les autres cellules endothéliales, qui commencent à proliférer et à former un nouveau vaisseau. Ces cellules endothéliales perdent transitoirement leurs connexions serrées, ce qui entraîne la découverte de la membrane basale, qui est rapidement digérée par les enzymes libérées par les cellules endothéliales. Certaines cellules endothéliales traversent la membrane basale digérée pendant la prolifération. Tout ce processus rend possible l’allongement et la ramification du nouveau vaisseau sanguin jusqu’à ce que le signal de vasculogenèse disparaisse. Les extrémités des vaisseaux sanguins fusionnent avec d’autres vaisseaux sanguins pour former des circuits fermés et permettre le flux de sang sans terminaisons mortes.
Des régions avec des progéniteurs de cellules endothéliales ont été trouvées dans l’aorte dorsale et l’endocarde. Les cellules mésenchymateuses peuvent être différenciées des cellules endothéliales de l’endocarde et forment la valve tricuspide et certains fibroblastes du cœur, mais pas les cardiomiocytes. Les cellules endothéliales sont si sensibles aux signaux externes que le maintien de l’intégrité de l’endothélium est un processus actif, qui est médié par d’autres signaux comme le FGF. Le processus actif n’est pas seulement pour l’intégrité, mais aussi pour conserver le phénotype cellulaire. Lorsque les cellules endothéliales ne reçoivent pas de signaux appropriés, elles meurent par apoptose ou deviennent des cellules mésenchymateuses susceptibles de synthétiser une matrice extracellulaire abondante. La transition de la cellule endothéliale à la cellule mésenchymateuse est à l’origine de certaines maladies comme l’artériosclérose et la miocardite fibreuse.
Fonction
L’idée que l’endothélium n’est qu’une couche de revêtement passive des vaisseaux lymphatiques et sanguins doit être modifiée. Les fonctions de l’endothélium sont variées et essentielles pour l’organisme. En effet, il s’agit d’une structure physique des canaux cardio-vasculaires et lymphatiques, mais il régule également l’échange de molécules entre la lumière du vaisseau et les tissus environnants, et il influence les propriétés physiologiques du sang. Outre une barrière physique, les cellules endothéliales développent des fonctions sécrétoires, métaboliques et immunitaires. Ils modifient leur comportement physiologique sous l’influence de molécules telles que les facteurs de croissance, les coagulants et les anticoagulants, les lipoprotéines de basse densité, l’oxyde nitrique, la sérotonine, l’enképhaline et bien d’autres. Les cellules endothéliales ont des récepteurs pour toutes ces substances.
Barrière
Les cellules endothéliales forment une couche qui agit généralement comme une barrière entre le sang et les tissus environnants. La cohésion entre les cellules endothéliales est assurée par des jonctions cellulaires, telles que des jonctions serrées et des jonctions adhérentes. Des jonctions lacunaires ont également été observées, bien que leur fonction principale soit la communication entre les cellules adjacentes. Les cellules endothéliales peuvent moduler ces adhérences et modifier la perméabilité de la barrière, ce qui peut affecter non seulement les molécules mais également les cellules traversant l’endothélium. Cependant, dans certains organes comme le foie, les cellules endothéliales sont beaucoup plus emballées et laissent beaucoup d’espace libre, de sorte que l’endothélium peut difficilement être considéré comme une barrière.
Les images en microscopie électronique à transmission montrent de nombreuses vésicules dans le cytoplasme des cellules endothéliales. On pense qu’ils sont impliqués dans le transport intracellulaire entre les membranes apicale (face au sang) et basolatérale (face à la lame basale). Ce type de transport est connu sous le nom de transcytose. Il est intéressant de noter que les vésicules de transcytose sont plus abondantes dans les cellules endothéliales des capillaires que dans celles des vaisseaux sanguins plus gros. Cela indique que les cellules endothéliales des capillaires ont un échange plus intense de molécules entre le sang et les tissus, alors que dans les vaisseaux de grand diamètre, elles sont principalement impliquées dans la conduite du sang. Certaines cellules endothéliales, appelées fenestrées, ont des pores ou de très petits canaux qui relient directement le sang aux tissus environnants, permettant à certaines molécules de petite taille de traverser l’endothélium sans pénétrer dans le cytoplasme des cellules endothéliales (Figure 4). Enfin, il existe des organes à l’endothélium très perméable. Dans le foie, les sinusoïdes sont des vaisseaux sanguins où les cellules endothéliales laissent un espace libre entre elles, et une fonction de barrière n’existe guère.
De nombreux types de cellules voyagent dans le sang vers leurs organes cibles dans le corps. Là, ils traversent l’endothélium des vaisseaux sanguins, généralement au niveau des veines post-capillaires. Cela signifie que les cellules endothéliales doivent modifier les jonctions cellulaires pour laisser les cellules traverser la couche d’endothélium. Les leucocytes sortent du vaisseau sanguin en reconnaissant et en s’ancrant à des molécules spécifiques de la membrane apicale des cellules endothéliales. Les sélectines, les intégrines et les immunoglobulines sont responsables de la reconnaissance et de l’adhésion des leucocytes à la couche endothéliale. Les sélectines commencent l’ancrage des leucocytes, qui roulent sur la surface endothéliale. Cette adhérence initiale est faible et réversible.
De nombreux leucocytes sortent du sang pendant les processus inflammatoires pour se déplacer vers les tissus affectés. Les chimiokines sont des molécules attractives pour les leucocytes qui sont libérées par les tissus endommagés et liées au glycocalix des cellules endothéliales. Les leucocytes roulant sur la surface endothéliale ayant des chimiokines sont activés, l’adhérence cellule-cellule devient plus forte et les leucocytes restent à la place. L’activation du leucocyte conduit à l’activation de ses intégrines, qui reconnaissent les immunoglobulines de la cellule endothéliale. Ces immunoglobulines sont exprimées dans les membranes des cellules endothéliales après l’activation de la cellule par les chimiokines. L’adhésion cellule-cellule augmente la concentration de calcium dans les cellules endothéliales et entraîne une désorganisation des jonctions cellulaires et une rétraction du cytoplasme. De cette façon, les leucocytes peuvent se déplacer à la frontière des cellules endothéliales et traverser l’endothélium. Les molécules d’adhésion sont également impliquées dans ce mouvement des leucocytes.
Propriétés du sang
Les fonctions endothéliales sont plus complexes que le simple contrôle des molécules et des cellules traversant l’endothélium. Les cellules endothéliales sont également impliquées dans la pression artérielle, la coagulation et certaines autres propriétés sanguines.
On pense que le système circulatoire primitif est apparu il y a 600 millions d’années chez les invertébrés, mais il manquait d’endothélium. Les cellules endothéliales sont apparues il y a 100 millions d’années fournissant au sang un flux plus laminaire (non turbulent) et donc un échange gazeux plus efficace.
Les cellules endothéliales modulent la pression artérielle en libérant des substances qui agissent sur le muscle lisse des vaisseaux sanguins. Ils libèrent de l’oxyde nitrique (NO) et de la prostacycline, qui détendent le muscle lisse vasculaire. Ils libèrent également l’endothéline et le facteur activateur plaquettaire, tous deux diminuant le diamètre des vaisseaux sanguins. L’oxyde nitrique est libéré de manière constitutive et fournit un tonus musculaire approprié, inhibe l’agrégation plaquettaire et l’adhésion leucocytaire. L’endothéline est un vasoconstricteur puissant. La façon dont les cellules endothéliales décident de la molécule à libérer n’est pas encore claire, mais des mécanorécepteurs dans leurs membranes apicales capables de ressentir les propriétés de flux du sang peuvent être plausibles.
Dans des conditions normales, les cellules endothéliales libèrent des molécules dans le sang qui aident à maintenir une bonne fluidité. Ils agissent à deux niveaux: fluidité (anticoagulants) et prévention de l’agrégation plaquettaire (antithrombotiques). Les protéines C et S sont des molécules importantes affectant la fluidité du sang. La protéine C, formant un complexe avec la protéine S, inactive les facteurs de coagulation VIIIa et Va. La protéine S est synthétisée par les cellules endothéliales. De plus, le glycocalix endothélial contient un glycosaminoglycane similaire à l’héparine capable d’inactiver la thrombine.
Liées à leur fonction anticoagulante, les cellules endothéliales libèrent de l’oxyde nitrique et de la prostacycline, augmentant à la fois l’AMP cyclique dans les plaquettes et rendant l’agrégation plaquettaire plus difficile. Ces deux molécules sont libérées en continu dans le sang. Les cellules endothéliales ont des ectonucléases dans leurs membranes apicales, qui éliminent l’ATP et l’ADP, deux puissants promoteurs de l’agrégation plaquettaire. De plus, les cellules endothéliales libèrent une molécule activatrice qui transforme le plaminogène en plasmine, ce qui favorise l’élimination des thrombus.
Toutes ces voies moléculaires peuvent changer lorsque les cellules endothéliales reçoivent des signaux ou que les tissus sont endommagés, ce qui entraîne la coagulation sanguine et l’agrégation plaquettaire. Dans ces circonstances, les cellules endothéliales deviennent alors des participants actifs de la coagulation et de la thrombose.
Défense immunitaire
Les cellules endothéliales jouent un rôle majeur dans la défense immunitaire et sont impliquées dans deux mécanismes: la présentation des antigènes aux lymphocytes T et le recrutement des cellules immunitaires. Avec les macrophages, les cellules endothéliales peuvent présenter des antigènes aux lymphocytes T car elles expriment constitutivement le CMH-I (complexe majeur d’histocompatibilité) et peuvent être induites à exprimer le CMH-II, tous deux nécessaires à la présentation de l’antigène. Les cellules endothéliales sont capables d’activer la mémoire immunitaire, mais pas les nouveaux lymphocytes T. Il y a une activation bidirectionnelle entre la cellule endothéliale et les lymphocytes T, de sorte que les cellules endothéliales libèrent des molécules pour attirer les cellules inflammatoires et expriment des molécules d’adhésion pour ancrer les leucocytes sanguins.
Bibliographie
Cines BD, Pollak ES, Buck CA, Loscalzo J, Zimmerman GA, McEver RP, Pober JS, Wick TM, Konkle BA, Schwartz BS, Barnathan ES, McCrae KR, Hug BA, Schmidt A-M, Stern DM 1998. Cellules endothéliales en physiologie et en physiopathologie des troubles vasculaires. Le journal de la société américaine d’hématologie. 91:3527-3561
Fajardo LF. 1988. La complexité des cellules endothéliales. Journal américain de pathologie clinique. 92:241-250.
Michiels C. 2003. Fonctions des cellules endothéliales. Journal de physiologie cellulaire. 196:430-443