Da die meisten neuen Hydroxidionen entfernt werden, steigt der pH-Wert nicht sehr stark an.
Entfernung der Hydroxidionen durch Reaktion mit Wasserstoffionen
Denken Sie daran, dass bei der Ionisierung der Ethansäure einige Wasserstoffionen vorhanden sind.
![]()
![]()
Hydroxidionen können sich mit diesen zu Wasser verbinden. Sobald dies geschieht, gibt der Arzt Tipps, um sie zu ersetzen. Dies geschieht so lange, bis die meisten Hydroxidionen entfernt sind.
![]()
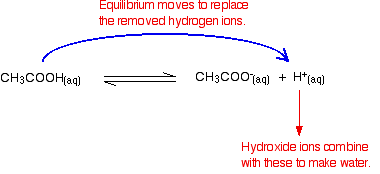
Da es sich um Gleichgewichte handelt, werden nicht alle Hydroxidionen entfernt – nur die meisten. Das gebildete Wasser re-ionisiert in sehr geringem Maße zu wenigen Wasserstoffionen und Hydroxidionen.
Alkalische Pufferlösungen
Wir nehmen eine Mischung aus Ammoniak- und Ammoniumchloridlösungen als typisch.
Ammoniak ist eine schwache Base, und die Position dieses Gleichgewichts wird gut nach links liegen:
![]()
![]()
Durch Zugabe von Ammoniumchlorid werden viele zusätzliche Ammoniumionen hinzugefügt. Nach dem Prinzip von Le Chatelier wird das die Position des Gleichgewichts noch weiter nach links kippen.
Die Lösung enthält daher diese wichtigen Dinge:
-
viel nicht umgesetztes Ammoniak;
-
viele Ammoniumionen aus dem Ammoniumchlorid;
-
genug Hydroxidionen, um die Lösung alkalisch zu machen.
Andere Dinge (wie Wasser und Chloridionen), die vorhanden sind, sind für das Argument nicht wichtig.
Hinzufügen einer Säure zu dieser Pufferlösung
Es gibt zwei Prozesse, die die Wasserstoffionen entfernen können, die Sie hinzufügen.
Entfernung durch Reaktion mit Ammoniak
Die wahrscheinlichste Grundsubstanz, mit der ein Wasserstoffion kollidieren wird, ist ein Ammoniakmolekül. Sie reagieren unter Bildung von Ammoniumionen.
![]()
![]()
Die meisten, aber nicht alle Wasserstoffionen werden entfernt. Das Ammoniumion ist schwach sauer, so dass ein Teil der Wasserstoffionen wieder freigesetzt wird.
Entfernung der Wasserstoffionen durch Reaktion mit Hydroxidionen
Denken Sie daran, dass bei der Reaktion zwischen Ammoniak und Wasser einige Hydroxidionen vorhanden sind.
![]()
![]()
Wasserstoffionen können sich mit diesen Hydroxidionen zu Wasser verbinden. Sobald dies geschieht, neigt das Gleichgewicht dazu, die Hydroxidionen zu ersetzen. Dies geschieht so lange, bis die meisten Wasserstoffionen entfernt sind.
![]()
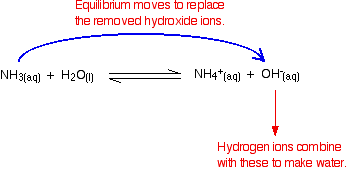
Da es sich um Gleichgewichte handelt, werden nicht alle Wasserstoffionen entfernt – nur die meisten.
Zugabe eines Alkalis zu dieser Pufferlösung
Die Hydroxidionen aus dem Alkali werden durch eine einfache Reaktion mit Ammoniumionen entfernt.
![]()
![]()
Da das gebildete Ammoniak eine schwache Base ist, kann es mit dem Wasser reagieren – und so ist die Reaktion leicht reversibel. Das bedeutet, dass wiederum die meisten (aber nicht alle) der Hydroxidionen aus der Lösung entfernt werden.
Berechnungen mit Pufferlösungen
Dies ist nur eine kurze Einführung. Es gibt mehr Beispiele, darunter mehrere Variationen, über 10 Seiten in meinem Chemie Berechnungen Buch.
Saure Pufferlösungen
Dies ist an einem konkreten Beispiel leichter zu erkennen. Denken Sie daran, dass ein Säurepuffer aus einer schwachen Säure und einem ihrer Salze hergestellt werden kann.
Nehmen wir an, Sie hätten eine Pufferlösung, die 0,10 mol dm-3 Ethansäure und 0 enthält.20 mol dm-3 Natriumethanoat. Wie berechnet man den pH-Wert?
In jeder Lösung, die eine schwache Säure enthält, besteht ein Gleichgewicht zwischen der nicht ionisierten Säure und ihren Ionen. Für Ethansäure haben Sie also das Gleichgewicht:
![]()
![]()
Die Anwesenheit der Ethanoat-Ionen aus dem Natriumethanoat hat das Gleichgewicht nach links verschoben, aber das Gleichgewicht besteht immer noch.
Das bedeutet, dass Sie die Gleichgewichtskonstante Ka dafür schreiben können:
![]()
![]()
Wenn Sie diese Gleichung zuvor mit einer schwachen Säure berechnet haben, haben Sie angenommen, dass die Konzentrationen der Wasserstoffionen und Ethanoationen gleich waren. Jedes Molekül Ethansäure, das sich aufspaltet, gibt von jeder Art von Ion eines.
Das gilt nicht mehr für eine Pufferlösung:
![]()
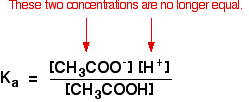
Wenn das Gleichgewicht noch weiter nach links verschoben wurde, ist die Anzahl der von der Ethansäure kommenden Ethanoat-Ionen im Vergleich zu denen von Natriumethanoat völlig vernachlässigbar.
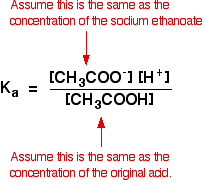
Wir gehen daher davon aus, dass die Ethanoat-Ionenkonzentration der Konzentration des Natriumethanoats entspricht – in diesem Fall 0,20 mol dm-3.
Bei einer schwachen Säureberechnung gehen wir normalerweise davon aus, dass so wenig Säure ionisiert ist, dass die Konzentration der Säure im Gleichgewicht mit der Konzentration der verwendeten Säure übereinstimmt. Dies gilt umso mehr, als das Gleichgewicht noch weiter nach links verschoben wurde.
Die Annahmen, die wir für eine Pufferlösung treffen, sind also:
![]()
Wenn wir nun den Wert für Ka kennen, können wir die Wasserstoffionenkonzentration und damit den pH-Wert berechnen.
Ka für Ethansäure ist 1,74 x 10-5 mol dm-3.
Denken Sie daran, dass wir den pH-Wert einer Pufferlösung berechnen möchten, die 0,10 mol dm-3 Ethansäure und 0,20 mol dm-3 Natriumethanoat enthält.
![]()
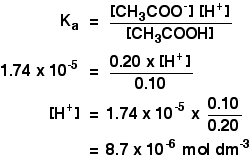
Dann müssen Sie nur noch den pH-Wert mit dem Ausdruck
pH = -log10
Sie haben immer noch den Wert für die Wasserstoffionenkonzentration auf Ihrem Rechner, drücken Sie also die Log-Taste und ignorieren Sie das negative Vorzeichen (um das Minuszeichen im pH-Ausdruck zu berücksichtigen).
Sie sollten eine Antwort von 5,1 auf zwei signifikante Zahlen erhalten. Sie können nicht genauer sein, weil Ihre Konzentrationen nur auf zwei Figuren gegeben wurden.