Einleitung
Die elektrische Isolierung der Lungenvenen (PV) ist der Eckpfeiler der Katheterablationsstrategien sowohl für paroxysmales als auch für persistierendes Vorhofflimmern (AF). Derzeit verfügbare Energiemodalitäten wie Radiofrequenz, Kryotherapie und laserbasierte PV-Isolation (PVI) sind durch langfristige PV-Wiederverbindungsraten begrenzt, die bestenfalls zwischen 22% und 38% liegen,1,2 mit anderen Studien, die über Raten von bis zu 62.5% berichten.3 Gewebeerwärmung (Radiofrequenz) oder Einfrieren (Kryotherapie), die beiden am häufigsten verwendeten Ansätze, tragen Gewebe wahllos ab, ohne Gewebeebenen zu unterscheiden. Folglich sind diese Energiequellen mit Kollateralschäden wie N. phrenicus und Ösophagusverletzung verbunden, einschließlich der gefürchteten Atrial-Ösophagus-Fistel. Darüber hinaus kann die Katheterablation mit anderen Komplikationen wie PV-Stenose, Steampops und dem Risiko von embolischen Schlaganfällen verbunden sein.4,5 Diese Sicherheitseinschränkungen werden leider durch das Fehlen einer konsistenten Läsionstransmuralität, einem bekannten Mechanismus für das Wiederauftreten von Vorhofflimmern, verstärkt.6 Daher bestand ein dringender Bedarf an einer ablativen Strategie, die nicht nur sehr wirksam, sondern auch äußerst sicher ist.Die gepulste Feldablation (PFA) ist eine nichtthermische Energiemodalität, die seit vielen Jahren sowohl für die Genelektrotransfer- als auch für die Tumorablation fester Organe verwendet wird.7,8 In jüngerer Zeit haben die Forscher ein einzigartiges Sicherheitsprofil und eine ablative Wirksamkeit im Zusammenhang mit seiner Fähigkeit nachgewiesen, selektiv auf Kardiomyozyten abzuzielen und gleichzeitig Kollateralgewebe zu schonen. Dies hat PFA als neuartige Energiequelle für die Herzablation ins Rampenlicht gerückt.
Grundlagen der PFA
PFA basiert weitgehend auf dem Konzept der Gleichstromablation, das in den 1980er Jahren vor der Verfügbarkeit von Hochfrequenzenergie kurzzeitig verwendet wurde.4 Spezifisch bezieht PFA die schnelle (Untersekunde) Anwendung von zeitweiligen elektrischen Impulsen der hohen Intensität mit ein, um ein elektrisches Feld über der Zellmembranlipiddoppelschicht zu schaffen, um nanoskalige Poren (Elektroporation) in der Zellmembran zu schaffen (Abbildung 1). Der Begriff reversible Elektroporation bezieht sich auf eine nicht permanente Porenbildung, wenn ein elektrisches Feld niedriger Intensität angelegt wird, das die Schwelle des Zielgewebes nicht überschreitet. Auf der anderen Seite bezieht sich irreversible Elektroporation auf die Schaffung permanenter Poren, wenn das elektrische Feld die Schwelle des Zielgewebes überschreitet. Diese permanenten Poren führen zu einem Auslaufen des Zellinhalts, der zum Zelltod führt (Abbildung 2). Das vielleicht wertvollste Merkmal der kardialen PFA ist ihre myokardiale Selektivität, was dazu führt, dass Kardiomyozyten die niedrigsten elektrischen Feldschwellenwerte (400 V / cm) aller Gewebetypen aufweisen.4,5
Abbildung 1
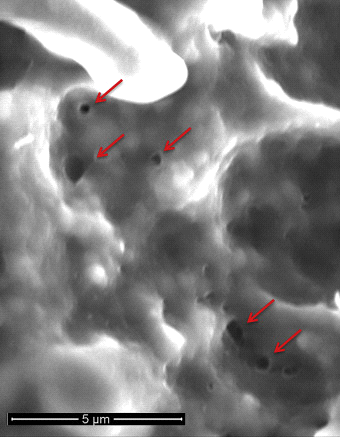
Abbildung 1

Abbildung 2
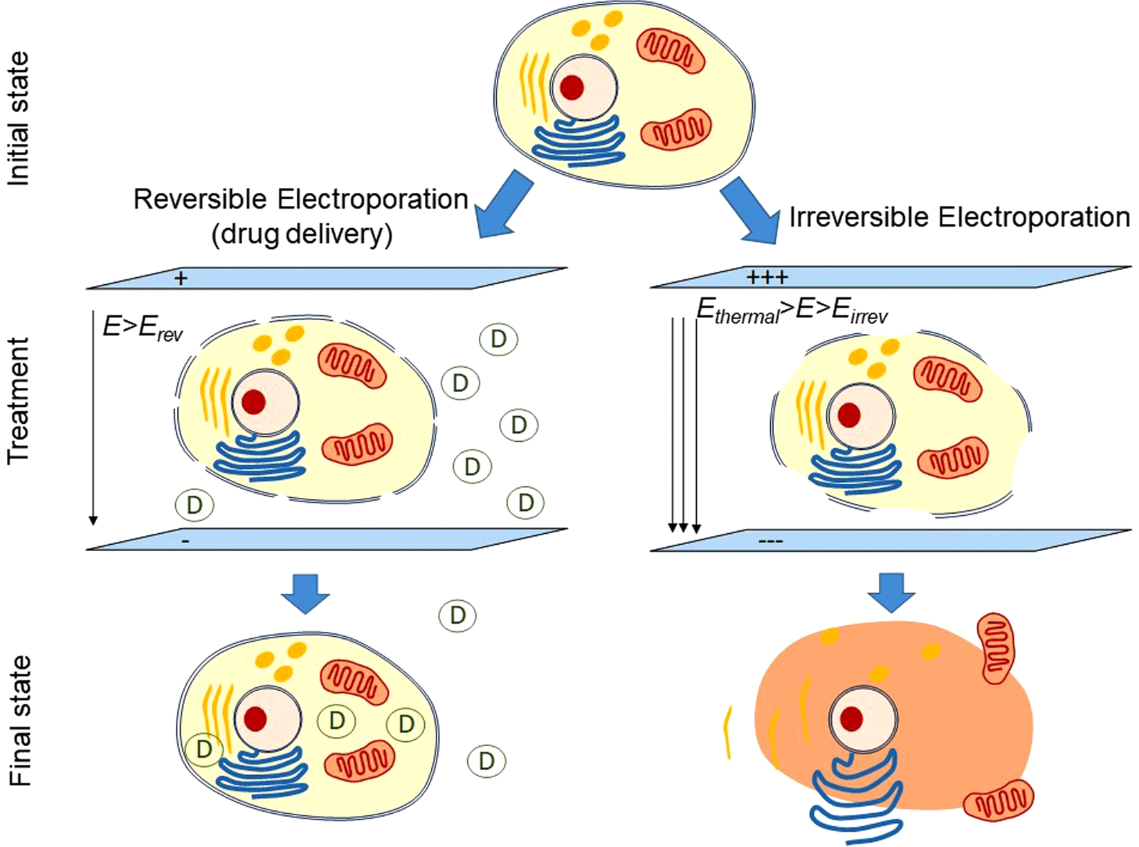
Abbildung 2

PFA-Technologie
PFA ist ein umfassender Begriff, der sich auf ein Spektrum von Puls- und Katheterdesignmerkmalen bezieht. Diese Merkmale sind eng mit dem Wirksamkeits- und Sicherheitsprofil von PFA verbunden. Ein Merkmal von PFA, das erhebliche Auswirkungen auf den klinischen Workflow hat, ist das Wellenformdesign. Monophasische Wellenformen verursachen typischerweise eine signifikante Muskelaktivierung, die die Verwendung von Vollnarkose und neuromuskulärer Lähmung erfordert. Umgekehrt haben zweiphasige PFA-Wellenformen ein begrenztes Engagement der Skelettmuskulatur gezeigt, so dass sie klinisch verwendet werden können, ohne dass Paralytika erforderlich sind.9
Präklinische Daten
Präklinische experimentelle Machbarkeitsdaten zu PFA als ablative Therapie für Myokardgewebe sind in den letzten zehn Jahren angefallen.4,10-14 PFA-Läsionen im Herzgewebe sind charakteristisch homogen und schonen die extrazelluläre Matrix innerhalb des Gewebegerüsts.4 Dies steht im Gegensatz zu wahllosen und störenden Läsionen, die mit thermischen Energiequellen erzeugt werden. In Bezug auf PFA und Vorhofgewebe haben die Forscher eine vollständig abtragende Myokardhülle mit 200 gezeigt Joule monophasische Anwendungen in Schweine-PV-Ostia ohne signifikante Narbenbildung oder Proliferation der Intima und der elastischen Lamina.11 Wichtig ist, dass trotz der Entstehung von Läsionen innerhalb der PV selbst die PV-Durchmesser nicht betroffen waren,10,11 Dies bestätigt den einzigartigen nicht-stenotischen Ablationsmechanismus von PFAs. In ventrikulärem Gewebe wurde gezeigt, dass PFA große Läsionen mit Schonung des Gefäßsystems und der Nerven innerhalb und neben der Läsion erzeugt.15 Zusätzlich wurde gezeigt, dass PFA die Schleimhaut der Speiseröhre schont und submuköse Schichten trotz absichtlicher Anwendung von PFA auf der Speiseröhre.Es wurde auch gezeigt, dass 16,17 PFA den Nervus phrenicus trotz mehrfacher Anwendung entlang seines Verlaufs nicht verletzt.18 Diese wichtigen Ergebnisse legen nahe, dass PFA ein einzigartiges Sicherheitsprofil aufweist, das es für die atriale Gewebeablation äußerst attraktiv macht. Die oben genannten präklinischen Bewertungen wurden alle mit einer monophasischen PFA-Wellenform durchgeführt. Neuere präklinische Daten mit neueren zweiphasigen PFA-Wellenformen haben ermutigend gezeigt, dass sie zusammenhängende, homogene, transmurale Vorhofläsionen erzeugen und relevante Endpunkte wie eine dauerhafte PV-Isolation erreichen.19 Wichtig ist, dass jede PFA-Wellenform als einzigartige Einheit betrachtet werden sollte und eine detaillierte präklinische Sicherheits- und Wirksamkeitsbewertung erfordert.
Klinische Daten
Reddy et al. waren die ersten, die die anfänglichen akuten klinischen Erfahrungen mit endokardialer und epikardialer PFA beschrieben. Sie führten eine offene, nicht randomisierte prospektive Studie zu PFA bei Patienten mit Vorhofflimmern durch.5 In dieser Studie wurde ein kundenspezifischer Over-the-Wire-Multispline-PFA-Katheter (FARAWAVE ) verwendet, um Endokardläsionen am PV-Antra bei 15 Patienten zu liefern. Dieser endokardiale PFA-Katheter hat 5 Splines mit jeweils 4 Elektroden und kann entweder eine Blumen- oder eine Korbkonfiguration annehmen. Dieses Design ermöglicht eine umlaufende, ostiale und antrale Abdeckung (Abbildung 3). Zusätzlich wurde ein linearer PFA-Katheter verwendet, um eine kombinierte PVI- und posteriore linksatriale Isolation (Box-Läsionsset) bei 7 weiteren Patienten während einer begleitenden Herzoperation zu erreichen. Monophasische gepulste Spannungswellenformen wurden in dieser Studie bipolar geliefert; Daher wurden alle Verfahren unter Vollnarkose durchgeführt. Endokardiale PVI war akut erfolgreich in allen 15 Patienten (100%) mit 3,26 ± 0,5 Läsionen/ PV und Energie Lieferzeiten von <60 Sekunden pro Patient. Die Box-Läsionen isolierten die hintere Wand erfolgreich bei 6 von 7 Patienten (86%). Das akute Sicherheitsprofil war ausgezeichnet ohne Verfahrenskomplikationen.
Abbildung 3
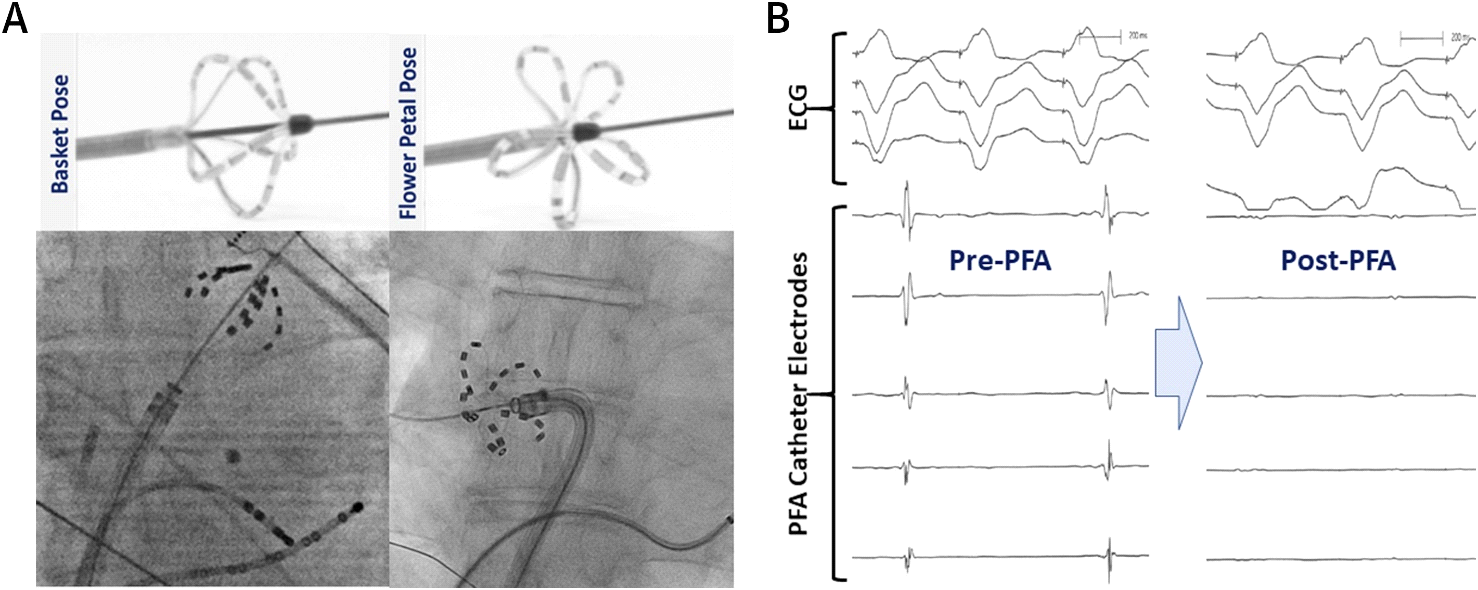
Abbildung 3

Anschließend veröffentlichte dieselbe Gruppe kürzlich die kombinierten Daten aus zwei nicht randomisierten klinischen Studien mit katheterbasiertem PFA bei Patienten mit paroxysmalem Vorhofflimmern.20 Zusammen schlossen diese Studien 81 Patienten mit symptomatischem paroxysmalem Vorhofflimmern ein, das gegen Antiarrhythmika resistent war, mit linksventrikulären Ejektionsfraktionen >40% und mit links Vorhof anteroposterior Dimension <5,5 cm. PFA-Impulse wurden kurz nach QRS-Beginn synchronisiert. Proprietäre bipolare PFA-Wellenformen wurden entweder monophasisch (900-1000 V pro Anwendung; erste Fälle) oder biphasisch (1800-2000 V pro Anwendung; die meisten Fälle) unter Verwendung des endokardialen PFA-Katheters (FARAWAVE) abgegeben. Eine akute PVI wurde bei 100% der Patienten erreicht. Aufgrund der Millisekundencharakteristik der Impulse betrug die zur Energieabgabe erforderliche Zeit nicht mehr als 3 min / Patient bei Haut-zu-Haut-Eingriffszeiten von 92,2 ± 27,4 min. Die dreimonatige PVI-Haltbarkeit stieg progressiv von 18% mit der anfänglichen monophasischen Wellenform auf 100% mit den optimierteren bipolaren Wellenformen in der letzten Kohorte in dieser Studie. Die geschätzte Arrhythmiefreiheit nach 12 Monaten betrug in dieser Studie 87 ± 5,6%.
Aus Sicherheitsgründen wurde eine einzige Perikardtamponade im Zusammenhang mit dem Eingriff berichtet, aber keine anderen unerwünschten Ereignisse wurden über die mittlere Nachbeobachtungszeit von 120 Tagen berichtet. Die Endoskopie wurde bei 29 Patienten im Mittel 3,4 Tage nach der Ablation durchgeführt und ergab keine Hinweise auf Ösophagusläsionen. Zusätzlich wurden 8 Patienten einer kontrastmittelverstärkten kardiovaskulären Magnetresonanztomographie nach dem Eingriff unterzogen, bei der trotz Verstärkung der unmittelbar angrenzenden linken Vorhofwand keine Ösophagusverstärkung festgestellt wurde. Dies unterstützt weiter das Fehlen von Ösophagusverletzungen mit PFA. Diese Energiequelle erzeugt unmittelbar nach einer Impulsabgabe schnell auflösende Mikrogasblasen.21 Die theoretische Möglichkeit, dass diese Gasblasen den kapillaren Blutfluss behindern und Organischämie und zerebrale Mikroembolien verursachen, wurde in dieser klinischen Erfahrung nicht beobachtet.
Loh et al. untersuchte auch die Machbarkeit und Sicherheit der Elektroporation für PVI in einer kleineren Serie von 10 Patienten mit paroxysmalem oder persistierendem Vorhofflimmern unter Verwendung eines benutzerdefinierten 14-polaren zirkulären Ablationskatheters. Ein akuter PVI wurde bei 100% (40 PV) Patienten mit mindestens 2 lichtbogenfreien 6 ms, 200 Joule-Anwendungen pro PV unter Verwendung einer monopolaren monophasischen Wellenform sicher erreicht.22 Die Sicherheit und PVI Haltbarkeit Ergebnisse dieser Serie wurden noch nicht berichtet.Zusammenfassend lässt sich sagen, dass PFA in der Lage ist, PV mit einem ausgezeichneten kurzfristigen Sicherheitsprofil und einer langfristigen Haltbarkeit schnell zu isolieren. Obwohl dies sehr vielversprechend ist, sind größere Studien mit längerem Follow-up erforderlich.
Fazit
PFA ist eine auffallend vielversprechende und neuartige nicht-thermische Ablationsstrategie, die bestimmte Einschränkungen zeitgenössischer AF-Ablationstechnologien überwinden kann. Die kurzen Verfahrenszeiten, das Fehlen von Kollateralschäden und die verbesserte Langzeitbeständigkeit von PVI unterscheiden diese Energiequelle von anderen. Der Ablationskatheter und das Pulsdesign haben sowohl Auswirkungen auf die Sicherheit als auch auf die Wirksamkeit. Dies muss berücksichtigt werden, da neuere PFA-Technologien ihren Weg in den klinischen Bereich finden.
- Hussein A, Das M, Riva S, et al. Die Verwendung der ablationsindexgesteuerten Ablation führt zu hohen Raten dauerhafter Pulmonalvenenisolation und Arrhythmiefreiheit bei Patienten mit anhaltendem Vorhofflimmern. Circ Arrhythmie Elektrophysik 2018;11:e006576.
- De Pooter J, Strisciuglio T, El Haddad M, et al. Bei der Mehrzahl der Patienten tritt nach einer einzelnen Pulmonalvenenisolierung keine Lungenvenenrekonfektion mehr auf. JACC Clin Electrophysiol 2019;5:295-305.
- Das M, Wynn GJ, Saeed Y, et al. Pulmonalvenen-Re-Isolation als Routinestrategie unabhängig von Symptomen: Die DRUCK randomisierte kontrollierte Studie. JACC Clin Electrophysiol 2017;3:602-11.
- Wittkampf FHM, van Es R, Neven K. Elektroporation und ihre Relevanz für die Herzkatheterablation. JACC Clin Electrophysiol 2018;4:977-86.
- Reddy VY, Koruth J, Jais P, et al. Ablation von Vorhofflimmern mit gepulsten elektrischen Feldern: Eine ultraschnelle, gewebeselektive Modalität für die Herzablation. JACC Clin Electrophysiol 2018;4:987-95.
- Darrat Y, Morales G, Di BL, Natale A, Elayi CS. Wie erreicht man eine dauerhafte Pulmonalvenen-Antrum-Isolation? J Vorhofflimmern 2014;6:1039.
- Paiella S, Butturini G, Frigerio I, et al. Sicherheit und Machbarkeit der irreversiblen Elektroporation (IRE) bei Patienten mit lokal fortgeschrittenem Bauchspeicheldrüsenkrebs: Ergebnisse einer prospektiven Studie. Dig Surg 2015;32:90-7.
- Heller R, Heller LC. In: Gene electrotransfer clinical trials. Adv Genet 2015;89:235-62.
- Jais P, Takigawa M, Sacher F, et al. Vergleich der biphasischen und monophasischen Pulsfeldablation in einem Tiermodell. J Kardiovaskuläre Elektrophysik 2019;1-28 (abstr).
- Witt CM, Sugrue A, Padmanabhan D, et al. Intrapulmonale Venenablation ohne Stenose: Ein neuartiger ballonbasierter Gleichstrom-Elektroporationsansatz. J Am Herz Assoc 2018;7:e009575.
- van Driel VJ, Neven KG, van Wessel H, et al. Lungenvenenstenose nach Katheterablation: Elektroporation versus Radiofrequenz. Circ Arrhythm Electrophysiol 2014;7:734-8.
- Takigawa M, Vlachos K, Viswanathan R, et al. Akute Ergebnisse der Isolierung der oberen Hohlvene und der Lungenvene mittels gepulster elektrischer Feldablation in einem Schweinemodell. Herzrhythmus 2018;15: S178-179 (abstr).
- Stewart MT, Haines DE, Verma A, et al. Intrakardiale Pulsfeldablation: Machbarkeitsnachweis in einem chronischen Schweinemodell. Herzrhythmus 2019;16: 754-64.
- Neven K, van Driel V, van Wessel H, van Es R, Doevendans PA, Wittkampf F. Größe der Myokardläsion nach epikardialer Elektroporationskatheterablation nach Subxiphoidpunktion. Circ Arrhythm Electrophysiol 2014;7:728-33.
- Kuroki K, Koruth JS, Pare M, et al. Erstbericht über pathologische Befunde der endokardialen Pulsfeldablation bei Schweinen. Herz Rhyhtm 2019;16:S583.
- Nils K., Hans-Peter R., Hans-Peter H., et al. Akute und langfristige Auswirkungen der Elektroporationsablation mit voller Leistung direkt auf die Schweine-Speiseröhre. Circ Arrhythmie Elektrophysik 2017;10:e004672.
- McElderry H., Walcott G., Viswanathan R., Long G., Sauter E., Mickelsen S. Sicherheit der gepulsten elektrischen Feldablation bei direkter Anwendung auf die Schweine-Speiseröhre. J Cardiovasc Electrophysiol 2018;29:657-78 (abstr).
- van Driel VJ, Neven K, van Wessel H, Vink A, Doevendans PA, Wittkampf FH. Geringe Anfälligkeit des rechten Nervus phrenicus für Elektroporationsablation. Herzrhythmus 2015;12: 1838-44.
- Kuroki K, Koruth J, Iwasawa J, et al. Pulmonalvenenisolation mit biphasischer Pulsfeldablation: Ein präklinischer Vergleich mit irrigierter Radiofrequenzablation. J Kardiovaskuläre Elektrophysik 2019;1-28 (abstr).
- Reddy VY, Neuzil P, Koruth JS, et al. Pulsfeldablation zur pulmonalen Venenisolation bei Vorhofflimmern. J Am Coll Cardiol 2019;74:315-26.
- van Es R, Groen MHA, Stehouwer M, Doevendans PA, Wittkampf FHM, Neven K. In-vitro-Analyse des Ursprungs und der Eigenschaften von gasförmigen Mikroembolien während der Katheterelektroporationsablation. J Kardiovaskuläre Elektrophysik 2019;30:2071-9.
- Loh P, van Es R, Groen MHA, et al. Pulmonalvenenisolation durch irreversible Elektroporation: Erste Erfahrung beim Menschen. Herzrhythmus 2019;16:S579.Jourabchi N, Beroukhim K, Tafti BA, Kee ST, Lee EE. Irreversible Elektroporation (NanoKnife) in der Krebsbehandlung. Gastrointestinale Intervention 2014;3: 8-18.
- López-Alonso B, Hernáez A, Sarnago H, et al. Histopathologische und ultrastrukturelle Veränderungen nach Elektroporation in Schweineleber mit Parallelplattenelektroden und Hochleistungsgenerator. Sci Rep 2019;9:2647.
Klinische Themen: Arrhythmien und klinische EP, Herzchirurgie, Dyslipidämie, Invasive kardiovaskuläre Angiographie und Intervention, Nichtinvasive Bildgebung, Perikarderkrankung, EP Grundlagenforschung, SCD / ventrikuläre Arrhythmien, Vorhofflimmern / supraventrikuläre Arrhythmien, Herzchirurgie und Arrhythmien, Fettstoffwechsel, Interventionen und Bildgebung, Magnetresonanztomographie
Schlüsselwörter: Atrial Fibrillation, Cardiac Tamponade, Feasibility Studies, Follow-Up Studies, Stroke Volume, Catheter Ablation, Anti-Arrhythmia Agents, Endoscopy, Electroporation, Magnetic Resonance Imaging, Cohort Studies, Phrenic Nerve, Myocytes, Cardiac, Pulmonary Veins, Cicatrix, Microscopy, Electron, Scanning, Feasibility Studies, Prospective Studies, Tissue Scaffolds, Catheter Ablation, Constriction, Pathologic, Heart Atria, Heart Rate, Esophageal Fistula, Cryotherapy, Cardiac Surgical Procedures, Endocardium, Electroporation, Cell Membrane, Electrodes, Extracellular Matrix, Cell Death, Muscle, Skelett, Leber, Anästhesie, Allgemein, Zellproliferation, Schlaganfall, Membranlipide, Neoplasmen
< Zurück zu den Auflistungen