Muskelplastizität
Der Skelettmuskel ist das größte Gewebe im Körper. Es ist sehr plastisch und kann als Reaktion auf eine Vielzahl von Umwelteinflüssen dramatische, nicht pathologische Schwankungen in Masse und Festigkeit erfahren. Nach Widerstandsübungen oder der Einwirkung von anabolen Steroiden erleiden die Muskeln eine Hypertrophie und erhöhen ihre Masse, Querschnittsfläche und Stärke (Aagaard, 2004; Schiaffino et al., 2013). Dieselben Parameter können stark abnehmen, wenn die Muskeln als Reaktion auf eine der folgenden Beleidigungen eine Atrophie auslösen: Hunger, Denervierung, Immobilisierung, Sepsis, Krebskachexie, Herzinsuffizienz, Diabetes, Nierenversagen, chronisch obstruktive Lungenerkrankung und erworbenes Immunschwächesyndrom (Schiaffino et al., 2013).
Die Folgen der Atrophie haben offensichtliche Auswirkungen auf die Gesundheit. Muskelschwäche trägt wesentlich zur Mortalität und Morbidität bei und ist mit dem erhöhten Risiko für alle Todesursachen verbunden (Metter et al., 2002). Tatsächlich kann die Verringerung der Muskelatrophie bei Krebskachexie das Leben erheblich verlängern (Zhou et al., 2010). Außerdem leiden viele ältere Menschen an Sarkopenie, einer langwierigen Muskelschwundstörung, die typischerweise nach dem 50. Lebensjahr beginnt und einen Verlust von etwa 1% der Muskelmasse pro Jahr mit sich bringt (Woo, 2017). Dies bedeutet, dass sarkopenische Personen im Alter von 80 Jahren etwa 40% ihrer Muskelmasse verloren haben, ein Schlüsselfaktor für Stürze, Gebrechlichkeit und Pflegeheimbesuche. Folglich ist das Verständnis der Mechanismen und potenziellen therapeutischen Reaktionen auf Atrophie von großem grundlegendem und klinischem Interesse (Ali und Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Hypothese der myonukleären Domäne
Der Skelettmuskel ist insofern ziemlich einzigartig, als die reifen Zellen synzytial sind und Hunderte von Kernen enthalten können. Dies ist eine notwendige Anpassung, da einzelne Muskelfasern enorm sein können und Längen von bis zu ~ 600 mm (23 in) erreichen (z. B. Sartoriusmuskel; Yang et al., 1998) und Volumina, die mehr als 100.000 mal größer sein können als eine typische mononukleäre Zelle (Bruusgaard et al., 2003). Die Beiträge mehrerer Kerne sind erforderlich, um große Mengen an mRNA zu produzieren, die benötigt werden, um die erstaunliche Proteinsynthese zu steuern, die erforderlich ist, um den kontraktilen Apparat zu erzeugen und aufrechtzuerhalten (Nevalainen et al., 2013).
Sowohl die plastische Natur des Muskels als auch seine synzytiale Organisation haben zu einer Kontroverse geführt, die erst kürzlich gelöst zu sein scheint — die „myonukleare Domänenhypothese“ (Qaisar und Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Diese Theorie hat ihren Ursprung in dem von Strassburger (1893) vorgeschlagenen Konzept der „Wirksphäre“, in dem er argumentierte, dass ein Kern nur ein diskretes Volumen von Zytoplasma tragen kann, wodurch die oberen Grenzen der Zellgröße definiert werden. Dieses Prinzip wurde von Gregory (2001) weiter ausgearbeitet, der argumentierte, dass zellulärer Desoxyribonukleinsäuregehalt und Volumen eng miteinander gekoppelt sind. Die synzytielle Natur des Skelettmuskels hilft diesen Zellen, diese Einschränkung zu überwinden. Die Hypothese der myonukleären Domäne besagt, dass zur Aufrechterhaltung des richtigen Verhältnisses von Kern zu Zytoplasma während der Hypertrophie neue Kerne hinzugefügt werden und mit der Atrophie verloren gehen.
Es gibt substantielle Daten, die zeigen, dass die Kernzahl mit Muskelhypertrophie zunimmt (Moss, 1968; Cabric und James, 1983; Egner et al., 2016), obwohl einige Kontroversen bestehen bleiben (Murach et al., 2018). Dieser Prozess wurde intensiv untersucht, und einige der zugrunde liegenden molekularen Mechanismen, die den Erwerb neuer Kerne während der Hypertrophie regulieren, wurden kürzlich definiert (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Diese überzähligen Kerne werden erworben, wenn abstammungsbeschränkte Stammzellen, typischerweise Satellitenzellen, mit Muskelfasern verschmelzen und ihre Kerne beisteuern (Brack und Rando, 2012; Bachman et al., 2018). Satellitenzellen befinden sich unter der Basalmembran und stoßen an das Sarkolemma (Katz, 1961; Mauro, 1961). Sie bleiben ruhig, bis sie entweder durch anabole Steroide wie Testosteron oder durch fokale Verletzungen nach Widerstandstraining stimuliert werden, an welchem Punkt sie wieder in den Zellzyklus eintreten und sich vermehren (Joubert und Tobin, 1995; Abreu et al., 2017). Einige der Tochterzellen verschmelzen mit der Muskelfaser und erleichtern sowohl die Reparatur als auch das Wachstum, während andere den Satellitenpool verhaften und wiederherstellen (Dumont et al., 2015; Goh und Millay, 2017). Die verbleibenden überschüssigen Zellen durchlaufen Apoptose (Schwartz, 2008).
Der umstrittene Aspekt der Hypothese der myonukleären Domäne ist die Behauptung, dass Myonkerne während der Atrophie verloren gehen. Es gibt viele Interventionen, die Atrophie in Tiermodellen induzieren, einschließlich: Immobilisierung, Denervierung und Sepsis (Fitts et al., 1986; Minnaard et al., 2005; O’Leary et al., 2012). In jedem Fall gibt es einen Nettoverlust sowohl der Muskelquerschnittsfläche (der primäre Assay) als auch des Auftretens apoptotischer Zellen im Gewebe (McCall et al., 1998; Schmidt et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). In diesen Studien wird die Apoptose in einer Vielzahl von Methoden gemessen, einschließlich Caspase-Aktivierung, mitochondriale endogene Freisetzung oder DNA-Fragmentierung . Diese Studien liefern überzeugende Daten, dass die Apoptose in der frühen Phase der Atrophie dramatisch zunimmt. Zum Beispiel in einer kürzlich durchgeführten umfassenden Studie (Guo et al., 2012), Guo et al. mäuse wurden einer 14-tägigen Suspension der Hintergliedmaßen unterzogen, eine Behandlung, die zu einer ~ 69% igen Verringerung des Muskelfeuchtgewichts und einer ~ 43,8% igen Verringerung der Querschnittsfläche im Vergleich zum nicht manipulierten kontralateralen Muskel führte. Die Autoren quantifizierten auch eine Reihe von Apoptose-Markern, einschließlich TUNEL-Färbung, Caspase-3-Spaltung / Aktivierung und die Spaltung von Poly (Adenosindiphosphat-Ribose) Polymerase (PARP), einem Protein, das an der DNA-Reparatur beteiligt ist. Jede dieser Apoptosemaßnahmen nahm nach der Suspendierung der Hintergliedmaßen signifikant zu. Während das Hauptaugenmerk dieses Papiers darauf lag, die positiven Auswirkungen der elektrischen Stimulation auf die Begrenzung der Atrophie nach einer Beleidigung zu bewerten, interpretieren sie und viele andere Forscher diese Art von Daten als starke Unterstützung für die Hypothese der myonukleären Domäne.
Aus zellbiologischer Sicht stellt der vermutete Verlust von Kernen innerhalb eines Synzytialgewebes wie Skelettmuskel ein großes praktisches Problem dar. Wie kann ein einzelner Kern so kompromittiert werden, dass sein Genom schnell kondensiert und fragmentiert, während seine Nachbarn bestehen bleiben und dazu beitragen, die Lebensfähigkeit der Muskelfaser zu erhalten? Da Apoptose typischerweise durch die Aktivierung der Klasse der Cysteinproteasen, die als Caspasen bekannt sind, vermittelt wird, ist nicht klar, welcher Mechanismus dazu dienen könnte, die Aktivität einer diffundierbaren Protease in einem gemeinsamen Zytoplasma einzuschränken.
Diese Frage wurde indirekt in einem anderen Syncytialzelltyp, dem menschlichen Syncytiotrophoblasten, einem Gewebe, das die Plazenta umgibt und etwa 5 × 1010 Kerne enthält, angesprochen (Mayhew et al., 1999). Wenn Apoptose im Syncytiotrophoblasten induziert wird, breitet sie sich als Welle mit einer Geschwindigkeit von etwa 5 Mikrometern pro Minute aus, bis das gesamte Gewebe betroffen ist (Longtine et al., 2012). Folglich gibt es keine „privilegierten“ Regionen innerhalb des synzytiellen Zytoplasmas und alle Kerne werden letztendlich zerstört.Eine der größten Herausforderungen bei der Analyse der Apoptose im Skelettmuskel besteht darin, dass es sich um ein sehr heterogenes Gewebe handelt, in dem sich etwa die Hälfte seiner Kerne außerhalb der Muskelfasern befindet (Schmalbruch und Hellhammer, 1977). Diese mononukleären Zellen umfassen Satellitenzellen, Endothelzellen, Fibroblasten, Perizyten und Makrophagen (Tedesco et al., 2010). Folglich ist es sehr schwierig zu bestimmen, auf welcher Seite des Sarkolemms sich ein Kern befindet und ob es sich um einen echten Myonkern handelt.
In-Vivo-Zeitraffer-Bildgebung von markierten Mausmuskelfasern
Trotz der großen Anzahl von Papieren, die Apoptose während Muskelatrophie demonstrieren, haben mehrere Autoren diese Ergebnisse in Frage gestellt (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen und Bruusgaard, 2008; Duddy et al., 2011; Qaisar und Larsson, 2014). Zum Beispiel unter Verwendung isolierter Muskelfasern in vitro, Duddy et al. während das Muskelfaservolumen im Laufe der Zeit abnahm, was auf einen atrophischen Prozess hindeutet, schien die Anzahl der Myonkerne stabil zu sein (Duddy et al., 2011).
In einer Reihe eleganter Experimente injizierte das Gundersen-Labor einzelne Extensor digitorum longus (EDL) – oder Soleus-Muskelmuskelfasern mit Farbstoffen, die die Kerne und das Zytoplasma in anästhesierten Mäusen unabhängig voneinander markierten (Bruusgaard und Gundersen, 2008; Bruusgaard et al., 2010). Dies ermöglichte es ihnen, jeden Kern innerhalb einzelner Muskelfasern im Laufe der Zeit in vivo zu identifizieren und dann sein Schicksal zu bewerten. Zum Beispiel wurden EDL-Muskeln durch die Ablation ihrer Hauptsynergisten zur Hypertrophie induziert (Bruusgaard et al., 2010). Zwischen den Tagen 6 und 11 nahm die Anzahl der Myonkerne um etwa 54% zu, und zwischen den Tagen 9 und 14 nahm die Querschnittsfläche um 35% zu (Abbildung 1). Diese Daten stimmen mit der Hypothese überein, dass Muskeln vor dem Hauptwachstum der Faser während der Hypertrophie überzählige Kerne erwerben.

Abbildung 1. Myonuclei werden während der Hypertrophie erworben, aber nicht während der Atrophie in der Maus verloren. Mikroskopische Aufnahmen der gleichen EDL-Muskelfaser im Laufe der Zeit nach der Induktion der Hypertrophie (obere Reihe) und der anschließenden Induktion der Atrophie (untere Reihe). Fluoreszenzmarkierte Oligonukleotide wurden verwendet, um die Kerne in vivo sichtbar zu machen. Die gestrichelten Linien stellen das Sarkolemma dar. Maßstabsbalken = 50 µm. (Nach Bruusgaard et al., 2010. Verwendet mit Genehmigung der Proceedings der Nationalen Akademie der Wissenschaften.)
Anschließend untersuchten sie das Schicksal dieser eindeutig identifizierbaren Myonkerne in denselben Muskelfasern, als sie zu einer Atrophie veranlasst wurden. Die Denervation führte zu einer Verringerung des Muskelfaservolumens um etwa 50%, jedoch zu keinem Verlust von Myonuclei (Abbildung 1; Bruusgaard et al., 2010). Das Versäumnis, den Kernverlust zu beobachten, war nicht auf den atrophischen Stimulus zurückzuführen, da sie die gleichen Ergebnisse erzielten, wenn die Muskeln als Reaktion auf Tetrodotoxin-induzierte Nervenblockade, Hintergliedsuspension, Krebskachexie oder Detraining zu einer Atrophie induziert wurden (Bruusgaard und Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). Tatsächlich untersuchten sie im Verlauf ihrer Studien mehr als 200.000 einzelne Myonkerne in atrophischen Muskeln und beobachteten nur 4 TUNEL-positive (apoptotische) Kerne, was einem Verlust von nur ~ 0,002% der Kerne entspricht (Bruusgaard et al., 2012). Diese Daten stützen stark die Hypothese, dass Skelettmuskelatrophie nicht von myonukleärem Tod begleitet wird.
Insektenmuskel als Modell
So mächtig diese Studien auch sind, es gibt einige Einschränkungen bei der Verwendung von Säugetiermodellen. Erstens verlassen sie sich ausnahmslos auf experimentelle Interventionen wie die Denervierung, um Muskelatrophie zu induzieren. Zweitens wird der kontralaterale Muskel typischerweise als interne Kontrolle verwendet, obwohl er auch einigen der gleichen Umweltsignale wie Stresshormonen ausgesetzt ist (Bonaldo und Sandri, 2013). Schließlich können Skelettmuskeln während der Entwicklung auch einen programmierten Zelltod (PCD) erleiden, und diese Modelle befassen sich selten mit der Rolle der Apoptose in diesen Zellen.
Ein alternatives Modell, das unter keiner dieser Einschränkungen leidet und die Untersuchung von Muskelkernen sowohl während der Atrophie als auch während der natürlich vorkommenden PCD ermöglicht, ist der intersegmentale Muskel (ISM) aus der Tabakfalkenmotte Manduca sexta. Die ISMs bestehen aus Schichten riesiger Muskelfasern, wobei jede Zelle etwa 5 mm lang und bis zu 1 mm im Durchmesser ist (Abbildung 2A). Die Ismen heften sich an die Segmentgrenzen innerhalb des Abdomens und erzeugen sowohl das Kriechverhalten der Larven als auch das Eklosionsverhalten (Emergenz) der erwachsenen Motte, wenn sie am Ende der Metamorphose aus der Puppenkutikula entweicht.
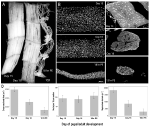
Abbildung 2. Retention von Myonuclei sowohl während der Atrophie als auch des Todes der intersegmentalen Muskeln (ISMs) von der Motte Manduca sexta. (A) Ismen aus drei Entwicklungsstadien: homöostatisch (Tage 15 der Puppenentwicklung; links); atrophisch (Tag 18; Mitte); und sterben (18 h Post-Eklosion; rechts). Skalenbalken entspricht ~ 1 mm (angepasst von Schwartz et al., 2016). (B) ISMEN aus denselben Entwicklungsstadien wurden geklärt und mit dem Kernfarbstoff DAPI angefärbt und mittels konfokaler Mikroskopie visualisiert (adaptiert von Schwartz et al., 2016). (C) ISM-Faserabschnitte (10 µm) wurden mit dem Kernfarbstoff DAPI angefärbt. Beachten Sie den dramatischen Verlust von Muskelprotein (hellgrauer Bereich) während Atrophie und Tod, aber die Retention von Kernen in allen Stadien (angepasst von Schwartz et al., 2016). (D) Quantifizierung des ISM-Faservolumens (links), der Kernzahl (Mitte) und der Größe der myonukleären Domäne (rechts) während Homöostase, Atrophie und Tod. (Mittelwert ± Standardfehler.) (Adaptiert von Schwartz et al., 2016).
Am Tag 15 der normalen 18 Tage der Puppenentwicklung initiieren die ISMs ein hormonell ausgelöstes Programm der Atrophie, das 3 Tage später zu einem 40% igen Massenverlust zum Zeitpunkt der Eklosion führt (Abbildung 2A; Schwartz und Truman, 1983). Dieser dramatische Verlust an Muskelmasse entspricht dem bei 80-jährigen Personen mit Sarkopenie, findet jedoch über 3 Tage und nicht über 30 Jahre statt. Während die ISMEN an Masse verlieren, behalten sie normale physiologische Eigenschaften wie Ruhepotential und Kraft / Querschnittsfläche bei (Schwartz und Ruff, 2002). Die ISMs werden verwendet, um das Eklosionsverhalten am Ende von Tag 18 zu erzeugen und dann PCD zu initiieren, die beide durch ein Peptidhormon ausgelöst werden (Schwartz und Truman, 1982, 1983). .Im Gegensatz zu Säugetiermuskeln enthalten die ISMs keine Kapillaren, Satellitenzellen, Endothelzellen oder Perizyten, was bedeutet, dass praktisch alle Kerne im Gewebe innerhalb der Muskelfasern selbst liegen (Beaulaton und Lockshin, 1977). Wir verwendeten zwei unabhängige Methoden, um das nukleare Schicksal sowohl während der Atrophie als auch während des Todes in diesem Modell zu überwachen (Schwartz et al., 2016). Der erste war ein anatomischer Standardansatz. Wenn die ISMs Atrophie und Tod erfahren, gibt es dramatische Verringerungen sowohl des Volumens als auch der Querschnittsfläche der Fasern, aber grob war die Kernzahl unverändert (Abbildung 2B). Unter Verwendung von geschnittenem Gewebe für quantitative Studien stellten wir fest, dass die Faserquerschnittsfläche während der Atrophie um ~ 49% und in den frühen Todesstadien um weitere 30% abnimmt (Abbildungen 2C, D; Schwartz et al., 2016). Die Anzahl der Kerne änderte sich jedoch während desselben Zeitraums nicht, was bedeutet, dass die myonukleäre Domäne funktionell um 84% reduziert war.Die zweite Methode, die wir verwendeten, war die Messung des DNA-Gehalts einzelner Muskelfasern von Tieren am Tag 13, wenn die Muskeln homöostatisch sind, bis 18 h nach der Eklosion, wenn die Muskeln stark degeneriert sind (Schwartz et al., 2016). Wir haben den DNA-Gehalt von 420 einzelnen Zellen quantifiziert und festgestellt, dass es während der Entwicklung keinen signifikanten Verlust gab. Diese biochemischen Analysen stimmen gut mit den anatomischen Daten überein und legen nahe, dass die relative Konzentration sowohl der Kerne als auch der genomischen DNA funktionell zunahm, als die Muskeln verkümmerten und starben. Folglich deuten Daten von Mäusen und Motten darauf hin, dass Muskelkerne während der Atrophie (oder PCD) keine Apoptose erfahren, und führen zu der Schlussfolgerung, dass die Hypothese der myonukleären Domäne abgelehnt werden sollte.
Schlussfolgerungen
Diese Beobachtungen haben eine Reihe von Implikationen sowohl für das Verständnis der grundlegenden Biologie des Muskels als auch für die Entwicklung potenzieller therapeutischer Interventionen. Während es erhebliche Daten gibt, die das Vorhandensein von apoptotischen Kernen innerhalb des Gewebes nach atrophischen Beleidigungen melden, deuten neuere Daten darauf hin, dass es sich nicht um echte Myonkerne handelt, sondern um echte mononukleäre Zellen, die sich außerhalb der Muskelfaser befinden. Der Hauptgrund für diese Diskrepanz ist, dass die traditionellen Werkzeuge, die zum Nachweis von Apoptose verwendet werden, nicht die Auflösung haben, die erforderlich ist, um angemessen zu bestimmen, auf welcher Seite des Sarkolemms sich eine sterbende Zelle befindet. Methoden, die Myonkerne spezifisch markieren, entweder über in vivo Injektionen von Fluoreszenzfarbstoffen (Bruusgaard und Gundersen, 2008) oder über genetische Manipulationen zur Expression von Markerproteinen (Duddy et al., 2011), zeigen nur wenige, wenn überhaupt apoptotische Kerne innerhalb der markierten Fasern. Die jüngste Demonstration, dass Antikörper, die gegen proteinperizentriolares Material 1 (PCM1) gerichtet sind, nur authentische Myonkerne markieren, bietet ein vielversprechendes Werkzeug, das auf die traditionellen histologischen Materialien angewendet werden kann, die routinemäßig im Feld analysiert werden (Winje et al., 2018b).
Das Versagen der Skelettmuskulatur, Apoptose als Mechanismus zur Eliminierung von Myonuclei einzusetzen, ist nicht überraschend. Es scheint, dass reifer Skelettmuskel weitgehend von der Einleitung der Apoptose ausgeschlossen ist, da er die Expression potenter Überlebensproteine wie X-linked inhibitor of apoptosis Protein (XIAP) hochreguliert (Smith et al., 2009) und Apoptose-Repressor mit Caspase Recruitment Domain (ARC) (Xiao et al., 2011), während gleichzeitig geringe Mengen an Apoptosemediatoren wie apoptotischer Protease-Aktivierungsfaktor 1 (Apaf-1) exprimiert werden (Burgess et al., 1999). Dies ist teleologisch sinnvoll, da Muskeln extremen Störungen ausgesetzt sind, einschließlich einer Störung des Sarkolemms nach intensivem Training, so dass es katastrophal wäre, wenn sie den Zelltod auslösen würden, anstatt die Gewebereparatur und möglicherweise die Hypertrophie einzuleiten. Wie andere terminal differenzierte Zellen neigen Muskeln dazu, nicht-apoptotische Mechanismen einzusetzen, insbesondere autophagische PCD (auch als Typ-II-Degeneration bekannt) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014), wenn sie während der Entwicklung sterben.
Selbst wenn es einen Mechanismus gäbe, mit dem Muskeln selektiv auf einzelne Kerne abzielen könnten, ist nicht klar, ob dies von Vorteil wäre. Tatsächlich verleiht die Beibehaltung von „überschüssigen“ Kernen während der Atrophie dem Individuum einen deutlichen Vorteil, da Skelettmuskeln häufig Zyklen von Atrophie und Hypertrophie als Reaktion auf Umweltbedingungen wie die Verfügbarkeit von Nahrungsmitteln durchlaufen. Die Fähigkeit, sich schnell zu erholen, indem bereits vorhandene Myonkerne genutzt werden, kann eine wichtige Rolle bei der Anpassung spielen (Jackson et al., 2012) und helfen, das Phänomen des „Muskelgedächtnisses“ zu erklären (Staron et al., 1991; Gundersen, 2016). Es ist auf dem Gebiet der Bewegungsphysiologie gut dokumentiert, dass es viel einfacher ist, ein bestimmtes Maß an Muskelfitness durch Bewegung wiederzuerlangen, als es überhaupt zu erreichen, selbst wenn es eine lange Zeit des Umtrainings gegeben hat. Mit anderen Worten, der Ausdruck „Benutze es oder verliere es“ könnte genauer formuliert werden als „benutze es oder verliere es, bis du wieder daran arbeitest.“ Dies wurde direkt durch ein anderes Experiment aus dem Gundersen-Labor demonstriert, das zeigte, dass ein Muskel, sobald er neue Kerne erworben hat, diese lange nach Entfernung des hypertrophen Stimulus beibehält. Sie induzierten Muskelhypertrophie bei weiblichen Mäusen, indem sie sie 2 Wochen lang mit Testosteron behandelten und dann die Muskeln 3 Wochen nach dem Steroidentzug untersuchten (Egner et al., 2013). Das Muskelvolumen war auf den Ausgangswert zurückgekehrt, aber die neu erworbenen Kerne blieben auch 3 Monate später bestehen. Wenn die Muskeln überlastet wurden, um die Hypertrophie wieder zu initiieren, nahmen die mit Steroiden behandelten Muskeln schnell um 36% zu, während die Kontrollmuskeln nur um 6% zunahmen. Diese Daten deuten darauf hin, dass die „überschüssigen“ Kerne schnell mobilisiert werden könnten, um die Umschulung zu erleichtern.
Diese Beobachtungen haben potenzielle Auswirkungen auf die öffentliche Gesundheitspolitik. Es wurde gezeigt, dass Muskelwachstum, physiologische Funktion und Regenerationsfähigkeit mit zunehmendem Alter abnehmen, was hauptsächlich auf eine verringerte Proliferation von Satellitenzellen zurückzuführen ist (Blau et al., 2015). Folglich könnte Bewegung während der Adoleszenz, wenn das Muskelwachstum durch Hormone, Ernährung und einen robusten Satellitenpool verstärkt wird, funktionell dazu dienen, dass Individuen Myonkerne „banken“ können, auf die später im Leben zurückgegriffen werden könnte, um die Auswirkungen des Alterns zu verlangsamen und möglicherweise Sarkopenie vorzubeugen.
Darüber hinaus haben diese Daten Auswirkungen auf den Bereich des Leistungssports. Die Verwendung von anabolen Steroiden ist ein starker Stimulus für Muskelhypertrophie und die Zugabe neuer Myonkerne (Egner et al., 2013). Da diese Kerne lange nach dem Ende des Steroidgebrauchs bestehen bleiben, ziehen Sportler wahrscheinlich die Vorteile des illegalen Drogenkonsums ohne das Risiko einer Entdeckung.Zusammenfassend lässt sich sagen, dass die Hinzufügung neuer Kerne mit Muskelwachstum weitgehend akzeptiert wird, der apoptotische Verlust von Kernen mit Atrophie jedoch nicht unterstützt werden kann, was darauf hindeutet, dass eine strikte Interpretation der Hypothese der myonukleären Domäne nicht unterstützt werden kann. Stattdessen scheint es, dass einmal erworbene Myonkerne bestehen bleiben, selbst wenn ein Muskel atrophisch wird oder den Zelltod auslöst.
Autorenbeiträge
Der Autor bestätigt, alleiniger Mitwirkender dieses Werkes zu sein und hat es zur Veröffentlichung freigegeben.
Förderung
Die Arbeit für diese Publikation wurde aus Mitteln der Eugene M. and Ronnie Isenberg Professorship Endowment unterstützt. Dem Autor wurde keine Unternehmensunterstützung gewährt, und es werden keine kommerziellen Produkte erwähnt oder unterstützt.
Erklärung zum Interessenkonflikt
Der Autor erklärt, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Der Autor dankt Frau Christine Brown für die Unterstützung bei der Erstellung dieses Manuskripts und der Eugene M. und Ronnie Isenberg Professorship Endowment für die Unterstützung.
Aagaard, P. (2004). Muskeln „stärker“ machen: Bewegung, Ernährung, Drogen. In: J. Musculoskelet. Neuronal. Interagieren. 4, 165–174.
PubMed Abstract / Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M. und Hirabara, S. M. (2017). Satellitenzellaktivierung induziert durch aerobe Muskelanpassung als Reaktion auf Ausdauertraining bei Menschen und Nagetieren. Life Sci. 170, 33–40. doi: 10.1016/j.lfs.2016.11.016
PubMed Abstract / CrossRef Full Text / Google Scholar
Ali, S. und Garcia, J. M. (2014). Sarkopenie, Kachexie und Altern: Diagnose, Mechanismen und Therapiemöglichkeiten — ein Mini-Review. Gerontologie 60, 294-305. doi: 10.1159/000356760
PubMed Abstract / CrossRef Full Text / Google Scholar
Immer, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., und Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract / CrossRef Full Text / Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z. und Sieck, G. C. (2006). Denervierungseffekte auf die Größe der myonukleären Domäne von Rattenmembranfasern. In: J. Appl. In: Physiol. 100, 1617–1622. doi: 10.1152/japplphysiol.01277.2005
CrossRef Volltext / Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). Das präpubertäre Skelettmuskelwachstum erfordert einen Pax 7-exprimierenden myonukleären Beitrag aus Satellitenzellen. Entwicklung 145:167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M. und Dupont-Versteegden, E. E. (2015). In einem Rattenmodell der kritischen Krankheitsmyopathie werden in Muskeln mit unterschiedlichen Fasertypen unterschiedliche apoptotische Muskelwege aktiviert. J. Muskel Res. Zellmotil. 36, 243–253. ust-IDNR.: 10.1007/s10974-015-9410-8
PubMed Abstract | CrossRef Full Text / Google Scholar
Beaulaton, J. und Lockshin, RA (1977). Ultrastrukturelle Untersuchung der normalen Degeneration der intersegmentalen Muskeln von Anthereae polyphemus und Manduca sexta (Insecta, lepidoptera) unter besonderer Berücksichtigung der zellulären Autophagie. In: J. Morphol. 154, 39–57. doi: 10.1002/jmor.1051540104
PubMed Abstract | CrossRef Full Text / Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a stimuliert die myogene Stammzellmotilität und -transplantation, was zu einer verbesserten Muskelkraft führt. In: J. Cell Biol. 205, 97–111. doi: 10.1083/jcb.201310035
PubMed Abstract / CrossRef Full Text / Google Scholar
Blau, H. M., Cosgrove, B. D. und Ho, A. T. (2015). Die zentrale Rolle von Muskelstammzellen beim regenerativen Versagen mit zunehmendem Alter. Nat. Med. 21, 854–862. doi: 10,1038/nm.3918
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bonaldo, P. und Sandri, M. (2013). Zelluläre und molekulare Mechanismen der Muskelatrophie. Dis. Modell. Mech. 6, 25–39. doi: 10.1242/dmm.010389
CrossRef Volltext / Google Scholar
Brack, A. S. und Rando, T. A. (2012). Gewebespezifische Stammzellen: Lehren aus der Skelettmuskel-Satellitenzelle. Zellstammzelle 10, 504-514. doi: 10.1016/j.Stamm.2012.04.001
PubMed Abstract | CrossRef Full Text / Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D. und Gundersen, K. (2012). Keine Änderung der Myonuklearzahl während des Entladens und Nachladens der Muskeln. In: J. Appl. In: Physiol. 113, 290–296. doi: 10.1152/japplphysiol.00436.2012
PubMed Abstract / CrossRef Full Text / Google Scholar
Bruusgaard, J. C., und Gundersen, K. (2008). In-vivo-Zeitraffer-Mikroskopie zeigt keinen Verlust von murinen Myonuclei während Wochen der Muskelatrophie. J. Clin. Investieren. 118, 1450–1457. doi: 10.1172/JCI34022
PubMed Abstract | CrossRef Full Text / Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A. und Gundersen, K. (2010). Myonuclei, die durch Überlastungsübungen erworben wurden, gehen der Hypertrophie voraus und gehen beim Detraining nicht verloren. Prok. Natl. Acad. Sci. U.S.A. 107, 15111-15116. doi: 10.1073/pnas.0913935107
CrossRef Volltext / Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K. und Gundersen, K. (2003). Anzahl und räumliche Verteilung der Kerne in den Muskelfasern normaler Mäuse in vivo untersucht. In: J. Physiol. 551, 467–478. in: 10.1113/jphysiol.2003.045328
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Burgess, DH, Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Menschliche Skelettmuskelzytosole sind gegenüber der Cytochrom-c-abhängigen Aktivierung von Typ-II-Caspasen refraktär und es fehlt APAF-1. Zelltod unterscheiden. 6, 256–261. Ursprungsbezeichnung: 10.1038/sj.cdd.4400489
PubMed Abstract / CrossRef Full Text / Google Scholar
Cabric, M. und James, N. T. (1983). Morphometrische Analysen der Muskulatur von trainierten und untrainierten Hunden. Uhr. In: J. Anat. 166, 359–368. Ursprungsbezeichnung: 10.1002/aja.1001660309
PubMed Abstract / CrossRef Full Text / Google Scholar
Cheema, N., Herbst, A., McKenzie, D. und Aiken, J. M. (2015). Apoptose und Nekrose vermitteln den Verlust von Skelettmuskelfasern bei altersbedingten mitochondrialen enzymatischen Anomalien. Altern Zelle 14, 1085-1093. zertifikat: 10.1111/acel.12399
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Clarke, P. G. (1990). Entwicklungszelltod: morphologische Vielfalt und multiple Mechanismen. Anat. Umarmungen. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A. und Goldberg, A. L. (2015). Muskelschwund bei Krankheiten: molekulare Mechanismen und vielversprechende Therapien. Nat. Rev. Drug Discov. 14, 58–74. doi: 10.1038/nrd4467
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Duddy, WJ, Cohen, T., Duguez, S. und Partridge, T. A. (2011). Die isolierte Muskelfaser als Modell der ungenutzten Atrophie: Charakterisierung mit PhAct, einer Methode zur Quantifizierung von f-Aktin. Verwendbar bis. Cell Res. 317, 1979-1993. Ursprungsbezeichnung: 10.1016/j.yexcr.2011.05.013
PubMed Abstract / CrossRef Full Text / Google Scholar
Dumont, N. A., Wang, Y. X. und Rudnicki, M. A. (2015). Intrinsische und extrinsische Mechanismen, die die Funktion der Satellitenzellen regulieren. Entwicklung 142, 1572-1581. doi: 10.1242/Entwickler.114223
PubMed Abstract / CrossRef Full Text / Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E. und Gundersen, K. (2013). Ein zellulärer Gedächtnismechanismus unterstützt die Überlastungshypertrophie im Muskel lange nach einer episodischen Exposition gegenüber anabolen Steroiden. In: J. Physiol. 591, 6221–6230. in: 10.1113/jphysiol.2013.264457
PubMed Abstract | CrossRef Full Text / Google Scholar
Egner, I. M., Bruusgaard, J. C. und Gundersen, K. (2016). Die Erschöpfung der Satellitenzellen verhindert eine Faserhypertrophie im Skelettmuskel. Entwicklung 143, 2898-2906. doi: 10.1242/Entwickler.134411
PubMed Abstract / CrossRef Full Text / Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A. und Unsworth, B. R. (1986). Modelle der Nichtnutzung: ein Vergleich der Hintergliedmassenaufhängung und Immobilisierung. In: J. Appl. In: Physiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Sterbende Neuronen im Thalamus von erstickten Neugeborenen und Ratten sind autophagisch. Ann. Neurol. 76, 695–711. doi: 10.1002/Jahr.24257
PubMed Abstract / CrossRef Full Text / Google Scholar
Goh, Q. und Millay, D. P. (2017). Anforderung der myomaker-vermittelten Stammzellfusion für Skelettmuskelhypertrophie. elife 6. doi: 10.7554/eLife.20007
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Gregory, TR (2001). Zufall, Koevolution oder Kausalität? DNA-Gehalt, Zellgröße und das C-Wert-Rätsel. Biol. In: Rev. Camb. Philos. Soc. 76, 65–101. doi: 10.1017/s1464793100005595
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). Srf-abhängige parakrine Signale, die von Myofasern erzeugt werden, steuern die satellitenzellvermittelte Skelettmuskelhypertrophie. Zelle Metab. 15, 25–37. ursprungsbezeichnung: 10.1016/j.cmet.2011.12.001
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Gundersen, K. (2016). Muskelgedächtnis und ein neues zelluläres Modell für Muskelatrophie und Hypertrophie. In: J. Exp. Biol. 219, 235–242. doi: 10.1242/jeb.124495
PubMed Abstract / CrossRef Full Text / Google Scholar
Gundersen, K. und Bruusgaard, JC (2008). Kerndomänen während der Muskelatrophie: Kerne verloren oder Paradigma verloren? In: J. Physiol. 586, 2675–2681. in: 10.1113/jphysiol.2008.154369
PubMed Abstract / CrossRef Full Text / Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T. und Yeung, E. W. (2012). Die elektrische Stimulation beeinflusst die Proliferation und Apoptose von Satellitenzellen bei stressinduzierter Muskelatrophie bei Mäusen. Plus Eins 7: e30348. doi: 10.1371/Zeitschrift.pone.0053523
PubMed Abstract / CrossRef Full Text / Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). Die Erschöpfung der Satellitenzellen hemmt das Nachwachsen der Skelettmuskulatur bei Erwachsenen nach einer altersbedingten Atrophie nicht. Uhr. In: J. Phys. In: Cell Physiol. 303, S. 854-861. doi: 10.1152/ajpcell.00207.2012
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Joubert, Y. und Tobin, C. (1995). Die Testosteronbehandlung führt dazu, dass ruhende Satellitenzellen aktiviert und in den Zellzyklus im Levator-Ani-Muskel der Ratte rekrutiert werden. Dev. Biol. 169, 286–294. doi: 10.1006/dbio.1995.1144
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Katz, B. (1961). Die Abschlüsse der afferenten Nervenfaser in der Muskelspindel des Frosches. Philos. Transeuropäischen. R. Soc. Lond. In: B Biol. Sci. 243, 221–240.
PubMed Abstract / Google Scholar
Kletzien, H., Hare, A. J., Leverson, G. und Connor, N. P. (2018). Altersbedingter Effekt des Zelltods auf die Fasermorphologie und -anzahl im Zungenmuskel. Muskelnerv 57, E29-E37. doi: 10.1002/mus.25671
PubMed Abstract / CrossRef Full Text / Google Scholar
Kole, A. J., Annis, R. P. und Deshmukh, M. (2013). Reife Neuronen: für das Überleben gerüstet. Zelltod Dis. 4:e689. doi: 10.1038/cddis.2013.220
PubMed Abstract / CrossRef Full Text / Google Scholar
Li, TS, Shi, H., Wang, L. und Yan, C. (2016). Wirkung von mesenchymalen Stammzellen des Knochenmarks auf die Proliferation und Apoptose von Satellitenzellen bei immobilisierungsinduzierter Muskelatrophie bei Ratten. Med. Sci. Moni. 22, 4651–4660. ursprungsbezeichnung: 10.12659/MSM.898137
PubMed Abstract / CrossRef Full Text / Google Scholar
Lockshin, R. A. und Williams, C. M. (1965). Programmierter Zelltod-I. Zytologie der Degeneration in den intersegmentalen Muskeln der Pernyi-Seidenmotte. J. In: Insect Physiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstract / CrossRef Full Text / Google Scholar
Longtine, MS, Barton, A., Chen, B. und Nelson, DM (2012). Live-cell Imaging zeigt Apoptose initiiert lokal und breitet sich als eine Welle in Syncytiotrophoblasten in Primärkulturen von humanen Plazentazotten Trophoblasten. Seite 33, 971-976. doi: 10.1016/j.Plazenta.2012.09.013
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Mauro, A. (1961). Satellitenzelle der Skelettmuskelfasern. In: J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R. und Lammiman, M. J. (1999). Proliferation, Differenzierung und Apoptose im villösen Trophoblasten nach 13-41 Schwangerschaftswochen (einschließlich Beobachtungen an annulierten Lamellen und Kernporenkomplexen). Kapitel 20, 407-422. doi: 10.1053/plac.1999.0399.
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Aufrechterhaltung der myonukleären Domänengröße in Ratte Soleus nach Überlastung und Wachstumshormon / IGF-I-Behandlung. In: J. Appl. In: Physiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, MA, Lee, Y., et al. (2007). Caspase-3-Regulation der myonukleären Zwerchfelldomäne während einer durch mechanische Beatmung induzierten Atrophie. Uhr. In: J. Respir. Krit. Pflege Med. 175, 150–159. doi: 10.1164/rccm.200601-142OC
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., und Conwit, R. (2002). Skelettmuskelkraft als Prädiktor für die Gesamtmortalität bei gesunden Männern. In: J. Gerontol. Ein Biol. Sci. Med. Sci. 57, B359-B365. Ursprungsbezeichnung: 10.1093/gerona/57.10.B359
PubMed Abstract / CrossRef Full Text / Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H. und Hesselink, M. K. (2005). Skelettmuskelschwund und Kontraktionsleistung bei septischen Ratten. Muskelnerv 31, 339-348. doi: 10.1002/mus.20268
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Moss, F. P. (1968). Die Beziehung zwischen den Abmessungen der Fasern und der Anzahl der Kerne während des normalen Wachstums der Skelettmuskulatur bei Hausgeflügel. Uhr. In: J. Anat. 122, 555–563. Ursprungsbezeichnung: 10.1002/aja.1001220308
PubMed Abstract | CrossRef Full Text / Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J. J. und Peterson, C. A. (2018). Die Flexibilität der myonukleären Domäne stellt starre Annahmen über den Beitrag der Satellitenzellen zur Hypertrophie der Skelettmuskelfasern in Frage. Front. In: Physiol. 9:635. Ursprungsbezeichnung: 10.3389/fphys.2018.00635
CrossRef Volltext / Google Scholar
Nevalainen, M., Kaakinen, M. und Metsikko, K. (2013). Verteilung von mRNA-Transkripten und Translationsaktivität in Skelettmyofasern. Zellgewebe Res. 353, 539-548. ust-idnr.: 10.1007/s00441-013-1659- x
PubMed Abstract / CrossRef Full Text / Google Scholar
O’Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y. und Hood, D. A. (2012). Denervation-induzierte mitochondriale Dysfunktion und Autophagie im Skelettmuskel von Apoptose-defizienten Tieren. Uhr. In: J. Phys. In: Cell Physiol. 303, S. 447-454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S. und Ochala, J. (2018). SIRT1 reguliert die Kernzahl und Domänengröße in Skelettmuskelfasern. J. Cell. In: Physiol. 233, 7157–7163. zertifikat: 10.1002/jcp.26542
PubMed Abstract / CrossRef Full Text / Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B. und Sandri, M. (2013). Mechanismen, die das Wachstum und die Atrophie der Skelettmuskulatur regulieren. FEBS J. 280, 4294-4314. doi: 10.1111/febs.12253
PubMed Abstract | CrossRef Full Text / Google Scholar
Schmalbruch, H. und Hellhammer, U. (1977). Die Anzahl der Kerne in adulten Rattenmuskeln mit besonderem Bezug auf Satellitenzellen. Anat. Rec. 189, 169–175. doi: 10.1002/mit.1091890204
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Schwartz, L. M. (2008). Atrophie und programmierter Zelltod der Skelettmuskulatur. Zelltod unterscheiden. 15, 1163–1169. doi: 10.1038/cdd.2008.68
PubMed Abstract / CrossRef Full Text / Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W. und Bigelow, C. (2016). Die myonukleäre Domäne wird im Skelettmuskel weder während der Atrophie noch während des programmierten Zelltods aufrechterhalten. Uhr. In: J. Phys. In: Cell Physiol. 311, S. 607-615. doi: 10.1152/ajpcell.00176.2016
PubMed Abstract / CrossRef Full Text / Google Scholar
Schwartz, L. M. und Ruff, R. L. (2002). Veränderungen der kontraktilen Eigenschaften der Skelettmuskulatur während der entwicklungsprogrammierten Atrophie und des Todes. Uhr. In: J. Phys. In: Cell Physiol. 282, S. 1270-1277. doi: 10.1152/ajpcell.01275.2000
CrossRef Volltext / Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E., und Osborne, B. A. (1993). Treten alle programmierten Zelltode über Apoptose auf? Prok. Natl. Acad. Sci. U.S.A. 90, 980-984.
Google Scholar
Schwartz, L. M. und Truman, J. W. (1983). Hormonelle Kontrolle der metamorphen Entwicklungsraten beim Tabakhornwurm Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, L. M. und Truman, J. W. (1982). Peptid- und Steroidregulation der Muskeldegeneration bei einem Insekt. Wissenschaft 215, 1420-1421. doi: 10.1126/wissenschaft.6278594
PubMed Abstract / CrossRef Full Text / Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A. und Bass, J. J. (2000). Nukleare DNA-Fragmentierung und morphologische Veränderungen im adulten Kaninchenskelettmuskel nach kurzfristiger Immobilisierung. Zellgewebe Res. 302, 235-241. doi: 10.1007/s004410000280
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Smith, M. I., Huang, Y. Y. und Deshmukh, M. (2009). Die Differenzierung der Skelettmuskulatur ruft endogenes XIAP hervor, um den apoptotischen Weg einzuschränken. Plus Eins 4:e5097. doi: 10.1371/journal.pone.0005097
CrossRef Full Text | Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J. Appl. Physiol. 70, 631–640.
Google Scholar
Strassburger, E. (1893). Ûber die wirkungssphäre der kerne und die zellgrösse. Histol Beitr. 5, 97–124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., und Konwalinka, G. (2000). Altersabhängige Apoptose und Verlust von Rhabdosphinkter-Zellen. In: J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347(05)67106-6
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G. und Cossu, G. (2010). Reparatur der Skelettmuskulatur: Regeneratives Potenzial von Skelettmuskelstammzellen. J. Clin. Investieren. 120, 11–19. doi: 10.1172/JCI40373
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S. und Soja, H. (2002). Keine Abnahme der Myonuklearzahl nach Langzeitdenervierung bei reifen Mäusen. Uhr. In: J. Phys. In: Cell Physiol. 283, S. 484-488. doi: 10.1152/ajpcell.00025.2002
CrossRef Volltext / Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). Kachexie induziert keinen Verlust von Myonuklei oder Muskelfasern während xenotransplantiertem Prostatakrebs bei Mäusen. In: Acta Physiol. e13204. doi: 10.1111/apha.13204
CrossRef Volltext / Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, JC und Gundersen, K. (2018b). Spezifische Markierung von Myonuclei durch einen Antikörper gegen perizentriolares Material 1 an Skelettmuskelgewebeschnitten. In: Acta Physiol. 223:e13034. doi: 10.1111/apha.13034
CrossRef Volltext / Google Scholar
Woo, J. (2017). Sarkopenie. Clin. Geriatr. Med. 33, 305–314. Ursprungsbezeichnung: 10.1016/j.cger.2010.02.012
CrossRef Volltext / Google Scholar
Xiao, R., Ferry, A. L. und Dupont-Versteegden, E. E. (2011). Die Zelltodresistenz differenzierter Myotuben ist im Vergleich zu Myoblasten mit verbesserten antiapoptotischen Mechanismen verbunden. Apoptose 16, 221-234. ust-IDNR.: 10.1007/s10495-010-0566-9
PubMed Abstract / CrossRef Full Text / Google Scholar
Yang, D., Morris, S. F. und Sigurdson, L. (1998). Der Sartoriusmuskel: anatomische Überlegungen für rekonstruktive Chirurgen. Surg. Radiol. Anat. 20, 307–310. doi: 10.1007
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Zhong, H., Roy, R. R., Siengthai, B. und Edgerton, VR (2005). Auswirkungen der Inaktivität auf die Fasergröße und die Myonuklearzahl im Soleusmuskel der Ratte. In: J. Appl. In: Physiol. 99, 1494–1499. doi: 10.1152/japplphysiol.00394.2005
CrossRef Volltext / Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). Die Umkehrung von Krebskachexie und Muskelschwund durch ACTINIB-Antagonismus führt zu einem verlängerten Überleben. Zelle 142, 531-543. doi: 10.1016/j.Zelle.2010.07.011
PubMed Abstract / CrossRef Full Text / Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A. und Murlasits, Z. (2017). Biochemische Wege der Sarkopenie und ihre Modulation durch körperliche Betätigung: eine narrative Überprüfung. Front. Med. 4:167. Ursprungsbezeichnung: 10.3389/fmed.2017.00167
CrossRef Volltext / Google Scholar