Größere Arene
Die meisten Arene, die einen einzigen Sechsring enthalten, sind flüchtige Flüssigkeiten wie Benzol und die Xylole, obwohl einige Arene mit Substituenten am Ring bei Raumtemperatur fest sind. In der Gasphase ist das Dipolmoment von Benzol Null, aber das Vorhandensein von elektronegativen oder elektropositiven Substituenten kann zu einem Netto-Dipolmoment führen, das die intermolekularen Anziehungskräfte erhöht und die Schmelz- und Siedepunkte erhöht. Beispielsweise hat 1,4-Dichlorbenzol, eine Verbindung, die als Alternative zu Naphthalin bei der Herstellung von Mottenkugeln verwendet wird, einen Schmelzpunkt von 52,7 ° C, was erheblich höher ist als der Schmelzpunkt von Benzol (5,5 ° C).
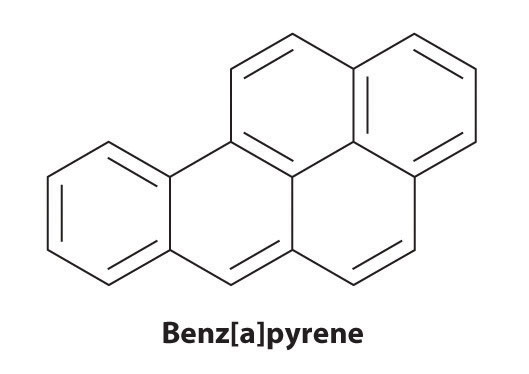
Bestimmte aromatische Kohlenwasserstoffe wie Benzol und Benzpyren sind starke Lebertoxine und Karzinogene. Im Jahr 1775 beschrieb ein britischer Arzt, Percival Pott, die hohe Inzidenz von Hodensackkrebs bei kleinen Jungen, die als Schornsteinfeger eingesetzt wurden, und führte dies auf ihre Rußbelastung zurück. Seine Schlussfolgerungen waren richtig: Benzpyren, ein Bestandteil von Kaminruß, Holzkohlegrillfleisch und Zigarettenrauch, war das erste chemische Karzinogen, das identifiziert wurde.
Obwohl Arene normalerweise mit drei C = C-Bindungen gezeichnet werden, ist Benzol etwa 150 kJ / mol stabiler als erwartet, wenn es drei Doppelbindungen enthalten würde. Diese erhöhte Stabilität ist auf die Delokalisierung der π-Elektronendichte über alle Atome des Rings zurückzuführen. Im Vergleich zu Alkenen sind Arene schlechte Nukleophile. Folglich durchlaufen sie keine Additionsreaktionen wie Alkene; Stattdessen durchlaufen sie eine Vielzahl von elektrophilen aromatischen Substitutionsreaktionen, bei denen –H am Aren durch eine Gruppe –E wie –NO2, –SO3H, ein Halogen oder eine Alkylgruppe in einem zweistufigen Prozess ersetzt wird. Der erste Schritt beinhaltet die Addition des Elektrophils (E) an das π-System von Benzol unter Bildung eines Carbokations. Im zweiten Schritt geht ein Proton vom benachbarten Kohlenstoff auf dem Ring verloren:
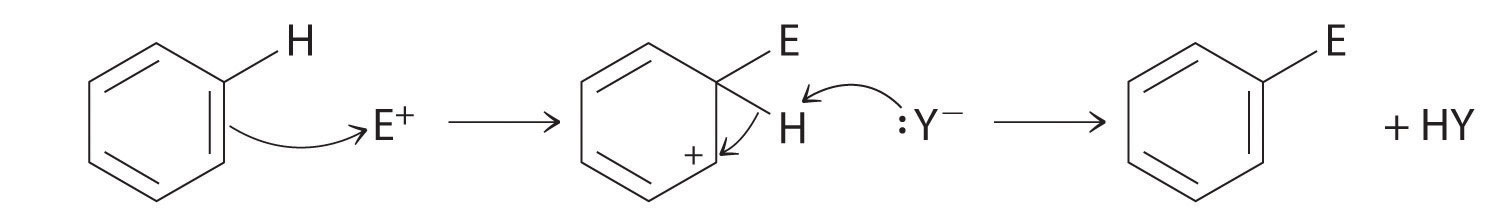
Das im ersten Schritt gebildete Carbokat wird durch Resonanz stabilisiert.
Arene unterliegen aufgrund der erhöhten Stabilität, die sich aus der Delokalisierung ihrer π-Elektronendichte ergibt, eher Substitutionsreaktionen als einer Eliminierung.
Viele substituierte Arene haben eine starke biologische Aktivität. Einige Beispiele umfassen gängige Medikamente und Antibiotika wie Aspirin und Ibuprofen, illegale Drogen wie Amphetamine und Peyote, die Aminosäure Phenylalanin und Hormone wie Adrenalin, wie unten gezeigt.
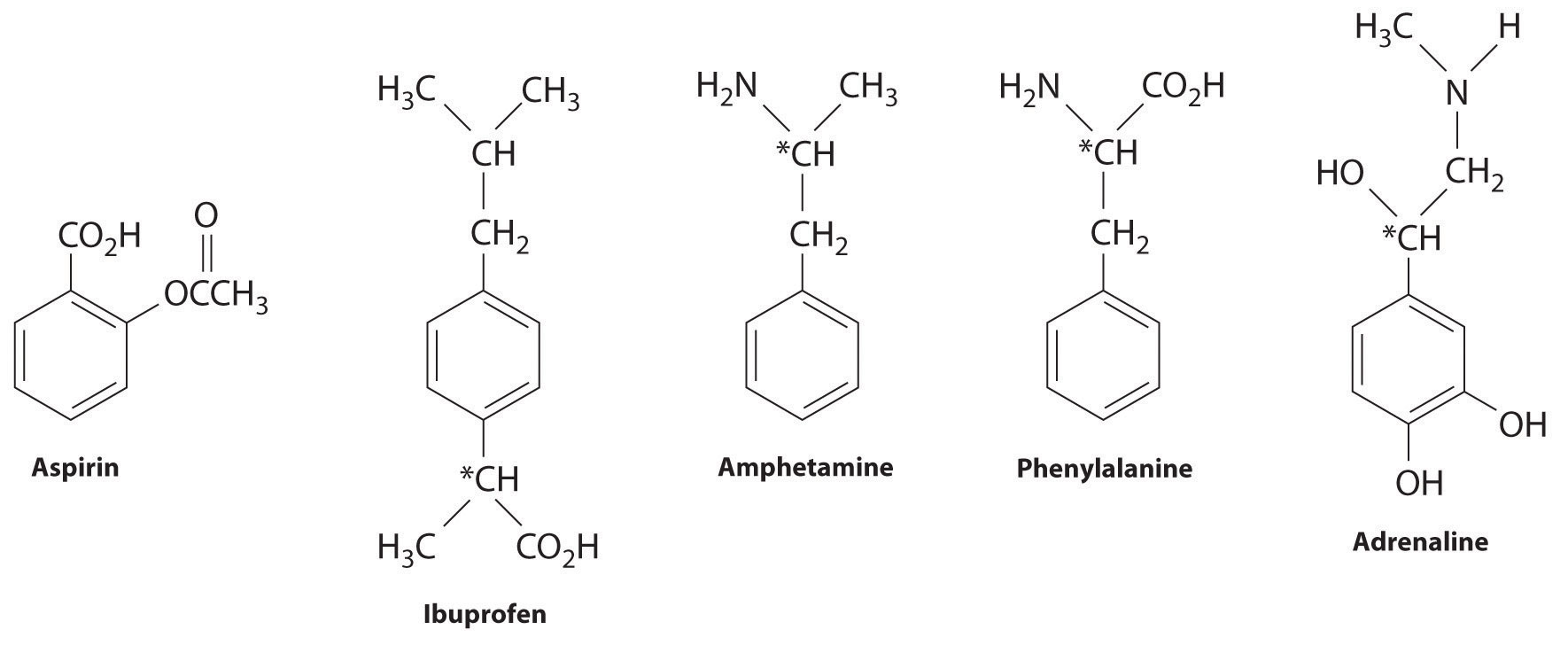
Aspirin (Antifieberaktivität), Ibuprofen (Antifieber- und entzündungshemmende Aktivität) und Amphetamin (Stimulans) haben pharmakologische Wirkungen. Phenylalanin ist eine Aminosäure. Adrenalin ist ein Hormon, das die Reaktion „Kampf oder Flucht“ auf Stress auslöst.