 vi har talt om ioner før. Nu er det tid til at komme ned til det grundlæggende. Atomnummeret på et element, også kaldet et protonnummer, fortæller dig antallet af protoner eller positive partikler i et atom. Et normalt atom har en neutral ladning med lige mange positive og negative partikler. Det betyder, at et atom med en neutral ladning er et, hvor antallet af elektroner er lig med atomnummeret. Ioner er atomer med ekstra elektroner eller manglende elektroner. Når du mangler en elektron eller to, har du en positiv ladning. Når du har en ekstra elektron eller to, har du en negativ ladning.
vi har talt om ioner før. Nu er det tid til at komme ned til det grundlæggende. Atomnummeret på et element, også kaldet et protonnummer, fortæller dig antallet af protoner eller positive partikler i et atom. Et normalt atom har en neutral ladning med lige mange positive og negative partikler. Det betyder, at et atom med en neutral ladning er et, hvor antallet af elektroner er lig med atomnummeret. Ioner er atomer med ekstra elektroner eller manglende elektroner. Når du mangler en elektron eller to, har du en positiv ladning. Når du har en ekstra elektron eller to, har du en negativ ladning.
 Hvad gør du, hvis du er et natrium (Na) atom? Du har elleve elektroner – en for mange til at have en hel skal fyldt. Du skal finde et andet element, der vil tage den elektron væk fra dig. Når du mister den elektron, vil du have fulde skaller. Hver gang et atom har fulde skaller, vi siger, at det er “lykkeligt.”Lad os se på klor (Cl). Klor har sytten elektroner og har kun brug for en mere for at fylde sin tredje skal og være “glad.”Klor vil tage din ekstra natriumelektron og efterlade dig med 10 elektroner inde i to fyldte skaller. Du er nu også et lykkeligt atom. Du er også en ion og mangler en elektron. Den manglende elektron giver dig en positiv ladning. Du er stadig elementet natrium, men du er nu en natriumion (Na+). Du har en mindre elektron end dit atomnummer.
Hvad gør du, hvis du er et natrium (Na) atom? Du har elleve elektroner – en for mange til at have en hel skal fyldt. Du skal finde et andet element, der vil tage den elektron væk fra dig. Når du mister den elektron, vil du have fulde skaller. Hver gang et atom har fulde skaller, vi siger, at det er “lykkeligt.”Lad os se på klor (Cl). Klor har sytten elektroner og har kun brug for en mere for at fylde sin tredje skal og være “glad.”Klor vil tage din ekstra natriumelektron og efterlade dig med 10 elektroner inde i to fyldte skaller. Du er nu også et lykkeligt atom. Du er også en ion og mangler en elektron. Den manglende elektron giver dig en positiv ladning. Du er stadig elementet natrium, men du er nu en natriumion (Na+). Du har en mindre elektron end dit atomnummer. 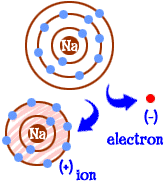 så nu er du blevet en natriumion. Du har ti elektroner. Det er det samme antal elektroner som neon (Ne). Men du er ikke neon. Da du mangler en elektron, er du heller ikke et komplet natriumatom. Som en ion er du nu noget helt nyt. Hele dit mål som et atom var at blive et “lykkeligt atom” med helt fyldte elektronskaller. Nu har du de fyldte skaller. Du har en lavere energi. Du mistede en elektron, og du er “glad.”Så hvad gør dig interessant for andre atomer? Nu hvor du har opgivet elektronen, er du ret elektrisk attraktiv. Andre elektrisk ladede atomer (ioner) af den modsatte ladning (negativ) ser nu på dig og ser en god partner at binde med. Det er her klor kommer ind. Det er ikke kun klor. Næsten enhver ion med en negativ ladning vil være interesseret i at binde med dig.
så nu er du blevet en natriumion. Du har ti elektroner. Det er det samme antal elektroner som neon (Ne). Men du er ikke neon. Da du mangler en elektron, er du heller ikke et komplet natriumatom. Som en ion er du nu noget helt nyt. Hele dit mål som et atom var at blive et “lykkeligt atom” med helt fyldte elektronskaller. Nu har du de fyldte skaller. Du har en lavere energi. Du mistede en elektron, og du er “glad.”Så hvad gør dig interessant for andre atomer? Nu hvor du har opgivet elektronen, er du ret elektrisk attraktiv. Andre elektrisk ladede atomer (ioner) af den modsatte ladning (negativ) ser nu på dig og ser en god partner at binde med. Det er her klor kommer ind. Det er ikke kun klor. Næsten enhver ion med en negativ ladning vil være interesseret i at binde med dig.
Elektrovalens
bliv ikke bekymret for det store ord. Elektrovalens er bare et andet ord for noget, der har givet op eller taget elektroner og bliver en ion. Hvis du ser på det periodiske system, kan du bemærke, at elementer på venstre side normalt bliver positivt ladede ioner (kationer), og elementer på højre side får en negativ ladning (anioner). Denne tendens betyder, at venstre side har en positiv Valens, og højre side har en negativ valens. Valens er et mål for, hvor meget et atom ønsker at binde sig til andre atomer. Det er også et mål for, hvor mange elektroner der er begejstrede for binding med andre atomer.
der er to hovedtyper af binding, kovalente og elektrovalente. Du har måske hørt om udtrykket ” ioniske bindinger.”Ionbindinger er elektrovalente bindinger. De er kun grupper af ladede ioner, der holdes sammen af elektriske kræfter. Forskere kalder disse grupper “Ioniske agglomerater.”Når de er i nærværelse af andre ioner, er de elektrovalente bindinger svagere på grund af eksterne elektriske kræfter og attraktioner. Natrium-og klorioner alene har en meget stærk binding, men så snart du lægger disse ioner i en opløsning med H+ -, OH -, F-eller Mg++ – ioner, er der ladede distraktioner, der bryder Na-Cl-bindingen.
Se på natriumchlorid (NaCl) en gang til. Salt er et meget stærkt bånd, når det sidder på dit bord. Det ville være næsten umuligt at bryde disse Ioniske/elektrovalente bindinger. Men hvis du lægger det salt i noget vand (H2O), bryder bindingerne meget hurtigt. Det sker let på grund af vandets elektriske tiltrækning. Nu har du natrium (Na+) og klor (Cl-) ioner, der flyder rundt om opløsningen. Du skal huske, at ionbindinger normalt er stærke, men de er meget svage i vand.
Related Video…
Wikipedia: Ions
Encyclopedia.com: Ions