en vektorburen sjukdom (specifikt en biologisk överföring snarare än mekanisk) är en där överföring av infektion i en population (värdpopulationen) endast sker via en andra population (vektorer). Vektorer är vanligtvis hematofagösa (blodmatande) leddjur som myggor, sandflugor eller fästingar. Det finns många sådana sjukdomar, vars dynamik är av stort intresse när det gäller att kontrollera infektion. Malaria, leishmaniasis, denguefeber och west Nile-virus är bara för att nämna några som för närvarande har en enorm social inverkan på mänskliga populationer.
varje år i regionen 225 miljoner människor smittas med malariaparasiten och 2009 resulterade cirka 781 000 av dessa i sjukdomsinducerad dödlighet. Historien är liknande för leishmaniasis där det finns cirka 12 miljoner människor globalt som tros vara smittade vid varje given tidpunkt och cirka 80 000 människor dör årligen från den allvarligaste formen, visceral leishmaniasis. Sådana sjukdomar är utbredd i utvecklingsländerna; en kombination av optimal livsmiljö för vektorer i tropiska regioner och brist på medicinsk hjälp leder till storskaliga endemier där.
mänskliga sjukdomar är inte det enda problemet; det finns många andra som infekterar andra klasser av värdar som också är av intresse, särskilt när det gäller att bevara hotade arter.
den typiska infektionsförloppet för vektorburen överföring, ignorerar sjukdom, värd eller vektorspecik, börjar med en infekterad vektor (en blodmatning eller sugande vuxen leddjur) som tar en blodmjöl från en mottaglig medlem av värdpopulationen. En gång biten har värden en chans att bli smittad med sjukdomen. I detta skede, om den är infekterad, anses värden vara exponerad men klarar inga negativa effekter från infektionen och kan inte överföra sjukdomen. Tiden efter att ha smittats men innan den blir smittsam kallas latensperioden. När parasiten har nått ett visst stadium i sin reproduktionscykel blir värden smittsam, varefter den, om den är biten, kan överföra sjukdomen till en mottaglig vektor genom sitt parasitinfekterade blod och slutföra överföringscykeln (visas i figuren nedan).
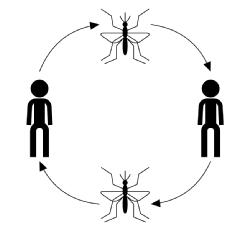
sjukdomsöverföring kännetecknas vanligtvis av:
- överflöd och rumslig spridning av både värdar och vektorer
- demografi
- en matningshastighet eller vektorlust att bita
- framgång eller misslyckande av överföring
typiskt matematiska modeller av vektorburna sjukdomar är baserade på en tvåpopulations si(r)-modell som uppvisar ”criss-cross” infektionsvillkor, där och
är infektionskraften för termer för värdar respektive vektorer:
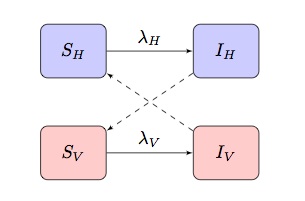
beroende på sjukdomen och populationen som modelleras kan detta anpassas för att införliva andra mer specifika egenskaper.
modellering av dynamiken hos vektorburna sjukdomar
det finns många olika typer av matematisk modell för vektorburen sjukdomsöverföring; helst försöker dessa hållas matematiskt traktabla och så enkla som möjligt samtidigt som man behåller den allmänna dynamiken i det biologiska systemet. Inte överraskande modeller från litteraturområdet kraftigt; från deterministisk till stokastisk, endemisk (inklusive födelse-och dödsräntor) eller epidemi (ett utbrott av begränsad varaktighet), som innehåller rumslig spridning, rumslig heterogenitet, latensperioder, åldersstruktur, förvärv och förlust av immunitet, flera stammar och många andra. Även när man bara överväger bara en specifik sjukdom kan variationerna i sjukdomen inom olika populationer leda till förändringar i inte bara parametriseringen utan också hur man kanske vill ta modelleringsmetoden.
en del av Kats arbete fokuserar på de förenklingar som ofta görs för att minska modellernas komplexitet. Detta arbete beaktar effekterna av att använda ”endast värd” överföringsmodeller som kvasi-jämviktsantagandet vid sjukdomsdynamik och även effekten av att utelämna latensperioden vid epidemiska förutsägelser.
Leishmaniasis
kompletteras med Erin
Human Afrikansk Trypanosomiasis (HAT)
Human Afrikansk trypanosomiasis (HAT), mer allmänt känd som sömnsjukdom, är en dödlig sjukdom som är endemisk över mycket av Afrika söder om Sahara. 70 miljoner människor bor i riskområden som täcker över en och en halv miljon kvadratkilometer. Medan förekomsten av HAT inte är lika hög som för andra vektorburna sjukdomar som malaria eller dengue (det fanns drygt 7000 rapporterade fall av HAT men 207 miljoner uppskattade malariafall 2012), bristen på kemisk profylax, den extremt obehagliga (och ofta dödliga) behandlingen och bristen på väsentlig vetenskaplig forskning har nu placerat HAT på WHO: s lista över försummade tropiska sjukdomar.
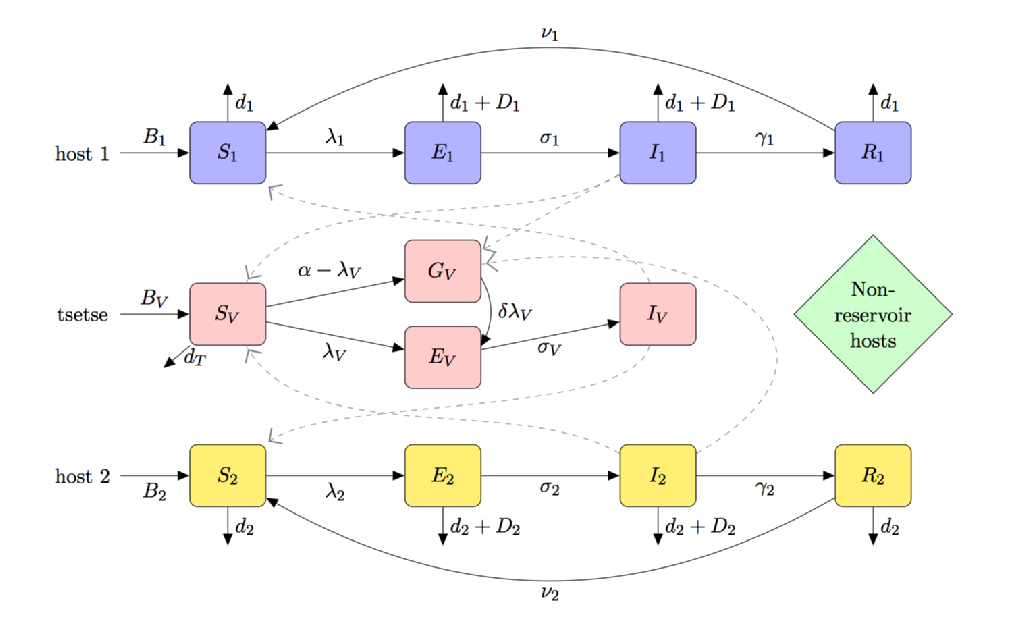
vektorn för hatt är tsetse; dess behov av blodfoder för att förhindra svält och en unik vektor-parasitinteraktion (orsakar ett ”teneralt känslighetsfenomen”) innebär att HATTMODELLERING skiljer sig tydligt från andra vektorburna sjukdomar som malaria.
figuren nedan är en fackkarikatyr av en modell för hatt som inkluderar:
- (partiell) teneral Fly känslighet
- Multi-värd arter (inklusive reservoar och icke-reservoar värdar)
- tsetse utfodring preferens
- svält av unfed tsetse
Bluetongue sjukdom (BTV)
Bluetongue är en virussjukdom (BTV) av idisslare som överförs av olika Culicoides genusbitande Midge arter. Symtom för boskap som är sjuk med BTV inkluderade obehag, hög feber och cyanos i tungan, vilket ger sjukdomen sitt namn. Bland får BTV sjukdom har en hög tillhörande dödlighet. Fram till slutet av 1990-talet var det europeiska sortimentet av BTV helt associerat med midgevektorn C. Imicola. I slutet av 90-talet och in i början av 2000-talet har det skett en tidigare aldrig tidigare skådad expansion av BTV till områden i Europa som ingår i utbudet av andra midge-arter som C. Obsoletus-komplexet och närbesläktade midge-arter. Särskilt ett utbrott med ursprung i Nederländerna 2006 är det första registrerade exemplet på ett BTV-intrång till 50 grader nordlig latitud. Under senare somrar upptäcktes BTV-fall i norra Europa, inklusive i Belgien, Tyskland, Storbritannien och Danmark, vilket visade att Bluetongue kunde övervintra i den nordeuropeiska miljön. Ett förbryllande inslag i den nordeuropeiska Serologin av blåtunga är att sjukdomen orsakades av en distinkt stam (BTV-8) från de ansvariga för intrång i södra Europa, dvs. Spanien (BTV-4) och Italien (BTV-2).
att förutsäga effekterna av BTV-intrång och bästa utformning av boskapshantering och sjukdomsbekämpning kräver banbrytande modelleringsmetodik. En hel del förstås om epidemiologin av BTV, såsom en solid förståelse av den förväntade perioden av viremi för nötkreatur och fårvärdar och effekten av klimattemperaturen på inkubationstiden för Bluetongue inom dess midgevektor. Att uppskatta den spatio-temporala risken som orsakas av vektorspridning bort från infekterad värdboskap är dock fortfarande en betydande utmaning. Inferensproblemet här är multifaktoriellt som kräver inte bara parameterinferens utan också statistiskt principiellt modellval.
Malaria
Malaria följer den generiska överföringscykeln som tidigare beskrivits; vektorn är den kvinnliga myggan som tar hennes blodmjöl som en del av reproduktionsprocessen; hanarna av arten är nektavorious och spelar som sådan ingen roll i överföringscykeln. Utfodringsfrekvensen bestäms av detta biologiska behov, och så är den genomsnittliga utfodringshastigheten vanligtvis omkring en gång var fjärde dag och det antas vanligtvis att mättnad för en sats ägg uppnås inom denna måltid. Det finns många olika typer av malaria, vissa påverkar människor (detta kan orsakas av en av fyra olika typer av Plasmodium) och andra som påverkar djur. Släktet Anopheles ansvarar för överföring till människor, varav cirka 30 av 400 arter främst orsakar smittspridning.
en viktig funktion som påverkar malaria är temperatur; även om myggan ligger inom det givna området, är yttre temperaturer under ca 16C (exakt tempererat beroende av parasitens Art), det är inte tillräckligt varmt för att möjliggöra utveckling. I allmänhet, eftersom temperaturen ökar från 16C desto kortare inkubationsperiod med ett plötsligt stopp över ca 32C eftersom parasiten inte kan överleva förbi dessa temperaturer.
aviär Malaria och Hawaiian Honeycreeper
vissa system kan dock vara mycket mer komplexa än det allmänna exemplet som givits tidigare. Ett sådant exempel är Hawaiian Honeycreeper( Drepanididae); det lider inte bara de negativa effekterna av aviär Malaria (Plasmodium relictum) som överförs via myggan (Culex quinquefasciatus) utan också klimatförändringarna och predation. Samspelet mellan dessa dominerande faktorer är stort, med temperaturer och överflöd av rovdjur som påverkar sjukdomsförloppet och fåglarnas förmåga (eller oförmåga) att motstå utrotning. Dessutom uppvisar vissa arter av honeycreeper förmågan att ge resistens mot malaria, som inte lider några skadliga effekter från sjukdomen medan de förblir infektiösa (dessa kallas oftare bärare och oavsiktligt orsakar en infektionsreservoar genom att överleva den normala ”sjukdomsfria” livslängden men sprider fortfarande infektion.
detta arbete har publicerats som:
K. S. Rock et al. ”Modellerar framtiden för Hawaiian Honeycreeper: ett ekologiskt och epidemiologiskt Problem”. Ekologisk modellering (juni 2012)