den primära strukturen hos ett protein definieras som sekvensen av aminosyror som den består av. Denna sekvens bestämmer slutligen den form som proteinet antar, enligt de rumsliga begränsningarna på arrangemanget av atomerna i proteinet, de kemiska egenskaperna hos komponentens aminosyrarester och proteinets miljö.
peptidbindningarna som länkar aminosyrarester i en polypeptid bildas i en kondensationsreaktion mellan den sura karboxylgruppen av en aminosyra och den basiska aminogruppen av en annan aminosyra. I samband med en peptid kallas amidgruppen (CO–NH) peptidgruppen.
avgörande för en förståelse av proteinstrukturen är en kunskap om strukturen hos peptidbindningen. Linus Pauling, på 1930-talet, använde röntgendiffraktion för att undersöka arten av peptidbindningen bildad mellan två aminosyror. Han rapporterade att peptidgruppen (CO–NH) har en styv plan struktur. Denna struktur beror på interaktioner mellan elektroner av karbonylgruppens dubbelbindning och C–N-bindningen (Figur 2) så att den senare förvärvar partiella (cirka 40%) dubbelbindningsegenskaper.

denna effekt är ett exempel på resonans som kan ses som en delning av elektroner mellan bindningar. Eftersom enkelbindningar mellan två atomer är längre än dubbelbindningar mellan samma två atomer skiljer sig längderna för C–N och C=o-bindningarna i peptidgruppen från de som observerats för dessa bindningar i andra sammanhang där resonans inte uppstår. Således innebär den partiella dubbelbindningskaraktären hos C-N i peptidgruppen att denna bindning är kortare än vad som skulle förutsägas för en c–n-enkelbindning, medan C=O-bindningen, som har en partiell enkelbindningskaraktär på grund av resonans, är längre än vad som skulle förutsägas för en c=o-dubbelbindning. Bindningslängderna i peptidgruppen anges i Figur 3. Jämför c-N-bindningen av peptidgruppen med den mellan N och Ca (C-atomen till vilken aminogruppen och karboxylgruppen är fästa).

det finns två möjliga konformationer av den plana peptidbindningen: i trans-peptidgruppen är Ca-atomerna på motsatta sidor av peptidbindningen (figur 3a) och i cis-peptidgruppen är Ca-atomerna på samma sida av peptidbindningen (figur 3b).
-
Med tanke på det rumsliga arrangemanget och närheten av atomerna i cis och trans-konformationerna av peptidbindningen, vilken konformation tror du skulle gynnas?
-
trans-konformationen skulle vara energiskt mer gynnsam än cis-konformationen, eftersom den minimerar steriskt hinder.
generellt sett är peptidbindningar i trans-konformationen. Cis-former kan emellertid förekomma i peptidbindningar som föregår en prolinrest. I sådana fall är cis-formen stabilare än vanligt eftersom prolin-sidokedjan erbjuder mindre hinder. Icke desto mindre förekommer cis-peptidbindningar endast i cirka 10% av fallen av peptidbindningar som föregår prolinrester.
Med tanke på peptidgruppens plana natur kan en polypeptidkedja ses ha en ryggrad som består av en serie styva plana peptidgrupper kopplade av Ca-atomerna. Figur 4 visar en del av en polypeptid med två plana peptidgrupper i trans-konformationen. Observera att även om rotation inte är tillåten om peptidbindningarna, finns det potential för rotation runt Ca–n och Ca–C-bindningarna. Rotationsvinklarna, benämnda torsionsvinklar, om dessa bindningar specificerar konformationen av en polypeptidryggrad. Torsionsvinklarna om Ca–n-och Ca-C-bindningarna benämns Kubi (phi) och Kubi. (psi), respektive, och de definieras som 180 kg när polypeptiden befinner sig i den utökade plana konformationen, såsom illustreras i Figur 4.
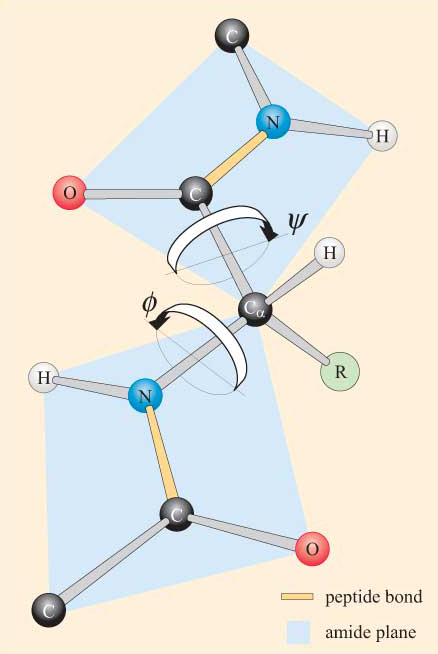
Du kommer inte att bli förvånad över att lära dig att steric begränsningar gäller för bisexuell och resp.
som ett resultat av dessa steriska begränsningar är endast vissa värden av Javi och Cori, och därmed konformationer av peptiden, tillåtna medan andra inte är det.
det är möjligt att beräkna dessa tillåtna värden för en given rest i samband med en polypeptid. Denna beräkning utförs genom att först bestämma avstånden mellan alla icke-bindningsatomer i två angränsande peptidgrupper (såsom de i Figur 4) vid alla möjliga värden för både ci och ci. Det görs lättast för en polypeptid som innehåller bara en typ av aminosyra. En konformationell komplott av Bisexuell mot en viss Rest är känd som en Ramachandran tomt (efter dess uppfinnare, G. N. Ramachandran). En sådan komplott gör det möjligt för oss att identifiera de konformationer (dvs. för ett särskilt värde av Jacobs och cube) som är steriskt gynnsamma eller ogynnsamma (som i Figur 5), enligt följande kriterier:
-
där det inte finns någon konflikt mellan van der Waals-radierna för icke-bindningsatomer, är en konformation tillåten. Dessa konformationer ligger i de blå områdena i Figur 5.
-
konformationer som kräver interatomiska avstånd vid gränsen för det som är tillåtet definieras som ’yttre gräns’ konformationer. De ligger i de gröna områdena i Figur 5.
-
teoretiska konformationer som kräver att två icke-bindningsatomer är närmare varandra än deras van der Waals radier tillåter är steriskt ’förbjudna’. Dessa ligger i de vita områdena i Figur 5.
Lägg märke till att värdena för 6-180 +180 + 180+. Genom att vrida peptidgruppen genom 360 ml återgår den naturligtvis till utgångsläget, och −180 ml och +180 kg motsvarar samma position. Således är den gröna remsan längst ner till vänster på tomten i Figur 5 sammanhängande med fältet längst upp till vänster.

-
Använd Bild 5 för att avgöra om följande värden ɸ och ψ är sterically gynnsam eller ogynnsam: (a) ɸ = 90º och ψ = 90º; (b) ɸ = −90º och ψ = 90º.
-
(a) ogynnsam; B) gynnsam.
Ramachandran-tomter kan konstrueras för polymerer av var och en av de 20 aminosyrorna. Det är viktigt att notera att Ramachandran-tomterna för många aminosyrarester i allmänhet är mycket lika, med endast tre regioner med gynnsamma eller tolererade konformationer (märkt 1-3 i tomten för poly-l-alanin i Figur 5). Skillnader förekommer dock. Till exempel, där sidokedjan (R i Figur 4) är förgrenad nära Ca, som i fallet med treonin, upptar den mer utrymme nära peptidryggraden och begränsar atomernas tillvägagångssätt i de närliggande peptidgrupperna. Som ett resultat är tillåtna konformationer (vinklarna i och IC) mer begränsade för polypeptider av grenade aminosyror.
-
prolin är också helt annorlunda än andra aminosyror när det gäller tillåtna konformationer och för polyprolin tolereras endast ozi −värden från −85 till-35. Tänker du på prolinens struktur, hur kan du förklara detta relativt smala intervall av tillåtna hCG-värden?
-
sidokedjan av prolin är kovalent bunden till n i aminogruppen, så i polyprolin kommer det att finnas mindre rotationsfrihet kring Ca–n-bindningen än med andra aminosyror. Följaktligen kommer tillåtna ozi-värden att vara relativt begränsade jämfört med andra aminosyror.
-
Figur 6 visar Ramachandran-diagrammet för glycinrester i en polypeptidkedja. Regionerna är färgkodade som i Figur 5. Vad kan du säga om de konformationer som glycin antar? Tänk på strukturen av glycin. Varför skiljer sig glycin från de andra resterna med avseende på dess konformationer?
-
glycin har mycket större konformationsfrihet än andra aminosyrarester, eftersom det är mindre steriskt hindrat.

Ramachandran-tomterna i figurerna 5 och 6 har genererats för respektive l-alanin och l-glycin på grundval av tillåtna och yttre gränsavstånd för interatomiska kontakter, bestämda från kända värden för van der Waals radier av atomerna (Tabell 1).
Tabell 1 van der Waals avstånd för interatomiska kontakter.
| Kontakttyp | normalt tillåtet / kg | yttre gräns / kg | |
|---|---|---|---|
| H···H | 2.0 | 1.9 |
3.0 |
de är därför prediktiva snarare än faktiska konformationella tomter. Vi kan naturligtvis använda röntgendiffraktion för att experimentellt bestämma de’ reala ’ värdena för Javi och Su för rester i en polypeptid. I Figur 7 har värdena för alla rester (med undantag av glycin och prolin) i ett antal olika strukturer bestämts genom röntgendiffraktion med hög upplösning och ritats på en Ramachandranplot. Vi kan se att det finns en slående korrespondens mellan förutsagda och faktiska konformationer. Observera dock att det finns vissa rester vars konformationer kartlägger de förbjudna områdena. De flesta av dessa rester kartlägger i regionen mellan ’tillåtna’ regioner 2 och 3, runt 0 = 0.

-
titta igen på Figur 4 och föreställ dig att du kan vrida den översta peptidgruppen genom 180 kg så att 0 = 0. Vilka grupper kommer sannolikt att strida i denna konformation?
-
n–h-grupperna av intilliggande peptidgrupper kommer i konflikt med varandra och tvingas i närheten.
konflikten i samband med dessa konformationer kan rymmas genom en liten grad av vridning av peptidbindningen. Således vrids peptidgruppen i sådana konformationer ur sin vanliga plana konformation.
ett begränsat antal förbjudna konformationer av särskilda restsubstanser kan tolereras i en polypeptid om den antagna konformationen som helhet är energiskt gynnsam. En polypeptid tenderar att vikas så att den antar den mest stabila konformationen. I denna konformation minimerar polypeptiden sin fria energi. I nästa avsnitt ska vi titta på denna högre nivå av proteinstruktur.