als je ooit een periodiek systeem van de elementen hebt bestudeerd (zie hieronder), dan weet je waarschijnlijk al dat deze tabel veel onthult over de chemische eigenschappen van de atomen waaruit onze wereld bestaat.
maar u beseft misschien niet dat elk vierkant op het periodiek systeem eigenlijk een familie van isotopen vertegenwoordigt — atomen die dezelfde naam en chemische eigenschappen hebben, maar verschillende massa ‘ s hebben.
om te begrijpen wat isotopen zijn en hoe we ze kunnen gebruiken, moeten we het binnenste van een atoom nader bekijken.

bouwstenen van materie
een atoom bestaat uit een ongelooflijk dichte kern (een kern genaamd) van protonen en neutronen, omgeven door een diffuse wolk van elektronen.
u kunt protonen en neutronen zien als hetzelfde soort deeltje met één belangrijk verschil: de protonen zijn positief geladen, terwijl neutronen geen lading dragen. Dit betekent dat protonen elektrische of magnetische velden kunnen “voelen”, terwijl neutronen dat niet kunnen.
de elektronen, die veel lichter zijn dan protonen of neutronen, dragen dezelfde ladingsgrootte als een proton, maar met het tegenovergestelde teken, wat betekent dat elk atoom met gelijke aantallen protonen en elektronen elektrisch neutraal is.
het zijn de elektronen die het chemische gedrag van een bepaald element bepalen.

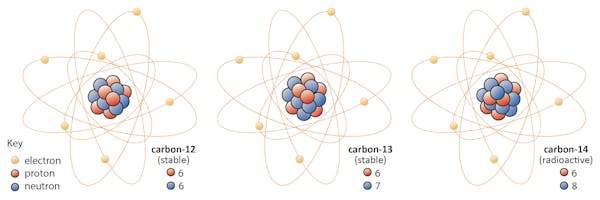
Isotopen van een element delen hetzelfde aantal protonen, maar hebben verschillende aantallen neutronen. Laten we koolstof als voorbeeld nemen.
Er zijn drie isotopen van koolstof gevonden in de natuur – koolstof-12, koolstof-13, en koolstof-14. Alle drie hebben ze zes protonen, maar hun neutronengetallen – respectievelijk 6, 7 en 8-verschillen allemaal. Dit betekent dat alle drie de isotopen verschillende atoommassa ‘ s hebben (koolstof-14 is de zwaarste), maar hetzelfde atoomnummer hebben (Z=6).
chemisch zijn alle drie niet te onderscheiden, omdat het aantal elektronen in elk van deze drie isotopen gelijk is.
dus verschillende isotopen van hetzelfde element zijn chemisch gezien identiek. Maar sommige isotopen hebben de mogelijkheid om deze regel te omzeilen door volledig te transformeren in een ander element.
Marching towards stability
Dit transformatieve vermogen dat sommige isotopen hebben, heeft te maken met het feit dat niet alle isotopen stabiel zijn.
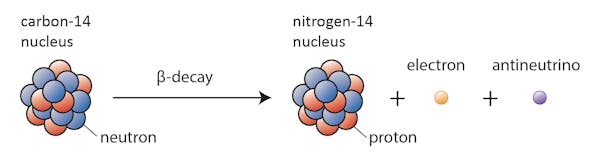
sommige isotopen – zoals koolstof-12-zullen gelukkig blijven bestaan als koolstof, tenzij er iets buitengewoons gebeurt. Anderen-koolstof-14, zeg maar-zullen op een gegeven moment vervallen in een stabiele isotoop in de buurt.
In dit geval verandert een van de neutronen in koolstof-14 in een proton, waardoor stikstof-14 ontstaat. Tijdens dit proces, dat bekend staat als beta-verval, zendt de kern straling uit in de vorm van een elektron en een antineutrino.
Er zijn veel factoren die een kern kunnen laten verval. Een van de belangrijkste is de verhouding van protonen tot neutronen die een bepaalde kern heeft. Als een kern te veel neutronen heeft (de definitie van “te veel” hangt af van hoe zwaar de kern is), is er een kans dat deze zal verval in de richting van stabiliteit.
hetzelfde geldt als een kern te veel protonen heeft. Dit is een van de redenen waarom sommige isotopen van een bepaald element radioactief zijn, terwijl andere dat niet zijn.
uit de buiken van sterren
vraagt u zich nu misschien af hoe al deze isotopen zijn ontstaan. Het blijkt dat deze vraag complex is, maar het adagium dat we allemaal gemaakt zijn van sterrenstof een beetje waar maakt.
sommige van de lichtere isotopen werden zeer vroeg in de geschiedenis van het heelal gevormd, tijdens de oerknal. Andere zijn het gevolg van processen die plaatsvinden in sterren of als gevolg van toevallige botsingen tussen zeer energetische kernen – bekend als kosmische stralen – in onze atmosfeer.
De meeste van nature bestaande isotopen zijn het uiteindelijke (stabiele of langlevende) product dat het resultaat is van een lange reeks kernreacties en verval.
in de meeste van deze gevallen moesten lichtkernen met genoeg energie aan elkaar slaan om de sterke kracht – een lijmachtige binding die ontstaat wanneer protonen en neutronen dicht genoeg bij elkaar komen om elkaar aan te raken-te overwinnen om de elektromagnetische kracht te overwinnen – die protonen uit elkaar duwt. Als de sterke kracht wint, binden de botsende kernen samen, of fuseren, om een zwaardere kern te vormen.
onze zon is hier een goed voorbeeld van. Een van de belangrijkste bronnen van energie is een reeks van fusiereacties en beta verval processen die waterstof omzetten in helium.

Transforming knowledge into tools
sinds de vroege jaren 1900, toen het bestaan van isotopen voor het eerst werd gerealiseerd, hebben kernfysici en chemici gezocht naar manieren om te bestuderen hoe isotopen kunnen worden gevormd, hoe ze verval, en hoe we ze zouden kunnen gebruiken.
Het blijkt dat de aard van isotopen – hun chemische uniformiteit, hun nucleaire onderscheidend vermogen – ze nuttig maakt voor een breed scala aan toepassingen op uiteenlopende gebieden als geneeskunde, Archeologie, landbouw, energieopwekking en mijnbouw.
als u ooit een PET-scan heeft gehad, heeft u baat gehad bij een bijproduct van het radioactieve verval van bepaalde isotopen (vaak medische isotopen genoemd). We produceren deze medische isotopen met behulp van onze kennis van hoe nucleaire reacties verlopen, met behulp van kernreactoren of versnellers genaamd cyclotrons.
maar we hebben ook manieren gevonden om gebruik te maken van natuurlijk voorkomende radioactieve isotopen. Koolstofdatering, bijvoorbeeld, maakt gebruik van de langlevende isotoop koolstof-14 om te bepalen hoe oud objecten zijn.
onder normale omstandigheden wordt koolstof-14 geproduceerd in onze atmosfeer via kosmische straalreacties met stikstof-14. Het heeft een halfwaardetijd van ongeveer 5.700 jaar, wat betekent dat de helft van een hoeveelheid koolstof-14 zal zijn vergaan in die periode.

terwijl een biologisch organisme in leven is, neemt het ongeveer één koolstof-14-isotoop op voor elke triljoen stabiele koolstof-12-isotopen en blijft de koolstof-12 tot koolstof-14-verhouding ongeveer hetzelfde zolang het organisme leeft. Zodra het sterft, stopt de nieuwe opname van koolstof.
Dit betekent de verhouding tussen koolstof-14 en koolstof-12 veranderingen in de resten van dit organisme in de loop van de tijd.
als we koolstof extraheren met behulp van chemische methoden uit een monster, kunnen we een methode genaamd accelerator massaspectrometrie (AMS) toepassen om de afzonderlijke koolstofisotopen in gewicht te scheiden.
AMS maakt gebruik van het feit dat versnelde deeltjes met dezelfde lading maar met verschillende massa ‘ s afzonderlijke paden door magnetische velden volgen. Door gebruik te maken van deze afzonderlijke paden, kunnen we isotopenverhoudingen met ongelooflijke nauwkeurigheid bepalen.
zoals u kunt zien in deze voorbeelden, passen we onze kennis van isotopen op verschillende manieren toe. We produceren ze, detecteren ze, halen ze eruit, en bestuderen ze met het tweeledige doel om te begrijpen waarom de atoomkern zich gedraagt zoals hij doet, en hoe we haar kracht kunnen gebruiken voor ons voordeel.