så som du vet är Dmitri Mendeleev fadern till det periodiska bordet. Men visste du att det moderna periodiska systemet som vi använder faktiskt utvecklades av en forskare som heter Henry Moseley? Låt oss lära oss den fascinerande historien bakom det periodiska bordet.
Suggested Videos
modernt periodiskt bord
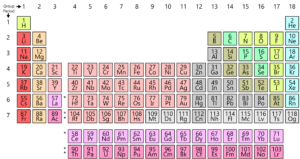
som du vet är alla element som finns på jorden ordnade i ett rutnät eller matris som kallas det moderna periodiska systemet. Dessa elements arrangemang är enligt ett mönster. Det periodiska systemet utvecklades faktiskt och av Mendeleev i början av 1800-talet. Men det var faktiskt perfekt av Henry Moseley, en engelsk fysiker 1913. Genom att göra anpassningar till den periodiska lagen förbättrades han på alla brister i Mendeleev-bordet. Låt oss ta en titt på denna utveckling.
bläddra bland fler ämnen under periodisk klassificering av element
- tidigare försök till klassificering av element
- elementens Position i det moderna periodiska systemet
- trender i det moderna periodiska systemet
använda atomnummer
Låt oss först titta på en atoms struktur. Varje atom består av en kärna som består av protoner och neutroner. Här har protonerna en positiv laddning och en neutron har ingen laddning. Nu omger elektroner (som bär en negativ laddning) kärnan. Nu är atommassantalet det totala antalet protoner och neutroner i en atom. Och atomnumret är antalet protoner i en atom. Detta atomnummer är helt unikt för varje element vilket innebär att varje element på planeten har sitt eget unika atomnummer.
det var Henry Moseley som föreslog ett bättre arrangemang än Mendeleev. Han ordnade elementen enligt deras atomnummer snarare än deras atommassa. Genom att göra det förbättrade han på föregående tabell och tog bort några av dess svårigheter och avvikelser.
position av väte
Mendeleev kunde aldrig räkna ut rätt position av väte i hans tabell. Eftersom väte antingen kan vinna eller förlora en elektron kan det hitta en plats i Grupp 1 eller 17. Dess elektroniska konfiguration liknar den för alkalimetaller. Även om det också kan kombineras med metaller och icke-metaller som bildar kovalenta bindningar som Halogener.
men i det moderna periodiska systemet finns det inget dilemma. Eftersom atomantalet väte är 1 Det är där det hittar sin lämpliga plats i början av tabellen.
isotoper
isotoper är olika atomer av ett element som var och en har samma antal protoner, men ett annat antal neutroner i sina kärnor. Detta innebär att även om deras atommassa varierar, är deras atomnummer detsamma. Som till exempel är kol-14 En radioaktiv isotop av kolatomen som har åtta neutroner.
medan detta presenterade ett problem för Mendeleev, eftersom tabellen berodde på atommassa, är det inte ett problem med det moderna periodiska systemet. Alla isotoper av elementen har inte separata platser på bordet.
ordning av vissa element
Mendeleev när man använder atommassa för att ordna element mötte ett annat problem. Det fanns vissa fall där det fanns en brytning av detta arrangemang så element med liknande egenskaper var i en grupp tillsammans. Ta exemplet med jod och Tellurium. Nu är jodens atommassa lägre än tellurium. Och ändå uttryckte Mendeleev det efter tellurium så att det kunde vara i samma grupp som fluor och klor.
i det moderna periodiska systemet blir atommassan irrelevant och element grupperas med liknande element baserat på deras atomnummer.
sällsynta jordartsmetaller
det moderna periodiska systemet löste ett annat problem genom att placera sällsynta jordartsmetaller som Cerium, lantan, Erbium etc i en separat tabell längst ner i det periodiska systemet för att inte störa den periodiska lagen.
löst exempel för dig
Q: Av alla 118 element som vi känner till, hur många element förekommer naturligt?