nyckeltermer
se till att du kan definiera och använda i sammanhanget nyckeltermerna nedan.
- Adams katalysator
- hydrogenering
Studieanteckningar
kemiska reaktioner som är heterogena har reaktanter som befinner sig i minst två olika faser (t.ex. gas med fast substans), medan homogena reaktioner uppträder i en enda fas (t. ex. gas med annan gas).
viss förvirring kan uppstå genom beskrivningen av katalysatorn som används i reaktionen mellan alkener och väte. Tre metaller-nickel, platina och palladium—används ofta, men en kemist kan inte bara placera en bit av en av dessa metaller i en blandning av alken och väte och få en reaktion. Varje metallkatalysator måste beredas på ett speciellt sätt:
- nickel används vanligtvis i en finfördelad form som kallas ”Raney nickel.”Den framställs genom att reagera En ni-Al-legering med NaOH.
- palladium erhålls kommersiellt ”stöds” på en inert substans, såsom kol, (Pd/C). Alkenen löses vanligtvis i etanol när Pd/C används som katalysator.
- platinum används som PtO2, Adams katalysator, även om det faktiskt är platinametall som är katalysatorn. Väte som används för att lägga till kol-kol dubbelbindningen minskar också platina(IV) oxid till finfördelad platinametall. Etanol eller ättiksyra används som lösningsmedel för alkenen.
andra typer av föreningar som innehåller flera bindningar, såsom ketoner, estrar och nitriler, reagerar inte med väte under de förhållanden som används för att hydrogenera alkener. Exemplen nedan visar reduktion av en alken, men de närvarande keton-och nitrilgrupperna förblir intakta och reduceras inte.

aromatiska ringar reduceras inte heller under de förhållanden som används för att minska alkener, även om dessa ringar verkar innehålla tre kol-kol dubbelbindningar. Som du kommer att se senare innehåller aromatiska ringar egentligen inga dubbelbindningar, och många kemister föredrar att representera bensenringen som en hexagon med en cirkel inuti den

snarare än som en hexagon med tre alternerande dubbelbindningar.
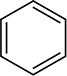
bensenringens representation kommer att diskuteras vidare i avsnitt 15.2.
reaktionen mellan kol-kol dubbelbindningar och väte ger en metod för att bestämma antalet dubbelbindningar närvarande i en förening. Till exempel reagerar en mol Cyklohexen med en mol väte för att producera en mol cyklohexan:

men en mol 1,4-cyklohexadien reagerar med två mol väte för att bilda en mol cyklohexan:
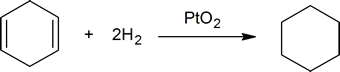
en kemist skulle säga att Cyklohexen reagerar med en ekvivalent väte och 1,4-cyklohexadien reagerar med två ekvivalenter väte. Om du tar en känd mängd av ett okänt, omättat kolväte och bestämmer hur mycket väte det kommer att absorbera, kan du enkelt bestämma antalet dubbelbindningar som finns i kolvätet (se Fråga 2, nedan).
tillsats av väte till en kol-kol dubbelbindning kallas hydrogenering. Den totala effekten av ett sådant tillägg är det reduktiva avlägsnandet av dubbelbindningsfunktionella gruppen. Regioselektivitet är inte ett problem, eftersom samma grupp (en väteatom) är bunden till var och en av dubbelbindningskolvarna. Den enklaste källan till två väteatomer är molekylärt väte (H2), men blandning av alkener med väte resulterar inte i någon märkbar reaktion. Även om den totala hydrogeneringsreaktionen är exoterm, förhindrar en hög aktiveringsenergi att den äger rum under normala förhållanden. Denna begränsning kan kringgås genom användning av en katalysator, såsom visas i följande diagram.
ett exempel på en alkenadditionsreaktion är en process som kallas hydrogenation.In en hydrogeneringsreaktion, två väteatomer tillsätts över dubbelbindningen av en alken, vilket resulterar i en mättad Alkan. Hydrogenering av en dubbelbindning är en termodynamiskt gynnsam reaktion eftersom den bildar en mer stabil (lägre energi) produkt. Med andra ord är produktens energi lägre än reaktantens energi; således är den exoterm (värme frigörs). Den frigjorda värmen kallas hydreringsvärmen, vilket är en indikator på en molekyls stabilitet.


katalysatorer är ämnen som ändrar hastigheten (hastigheten) för en kemisk reaktion utan att konsumeras eller visas som en del av produkten. Katalysatorer verkar genom att sänka aktiveringsenergin för reaktioner, men de förändrar inte den relativa potentiella energin hos reaktanterna och produkterna. Finfördelade metaller, såsom platina, palladium och nickel, är bland de mest använda hydrogeneringskatalysatorerna. Katalytisk hydrogenering sker i minst två steg, som avbildas i diagrammet. Först måste Alken adsorberas på katalysatorns yta tillsammans med en del av väte. Därefter skiftar två väten från metallytan till kolet i dubbelbindningen, och det resulterande mättade kolvätet, som är svagare adsorberat, lämnar katalysatorytan. Den exakta naturen och tidpunkten för de senaste händelserna är inte väl förstådd.

som visas i energidiagrammet är hydrogeneringen av alkener exoterm och värme frigörs som motsvarar kube (färgad grön) i diagrammet. Denna reaktionsvärme kan användas för att utvärdera den termodynamiska stabiliteten hos alkener med olika antal alkylsubstituenter på dubbelbindningen. Följande tabell visar till exempel upphettningarna av hydrogenering för tre C5H10-alkener som ger samma alkanprodukt (2-metylbutan). Eftersom en stor reaktionsvärme indikerar en hög energireaktant är dessa värmer omvänt proportionella mot stabiliteten hos alkenisomererna. Till en grov approximation ser vi att varje alkylsubstituent på en dubbelbindning stabiliserar denna funktionella grupp med lite mer än 1 kcal/mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

från mekanismen som visas här förväntar vi oss att tillsatsen av väte ska ske med syn-stereoselektivitet. Detta är ofta sant, men hydrogeneringskatalysatorerna kan också orsaka isomerisering av dubbelbindningen före vätetillsats, i vilket fall stereoselektivitet kan vara osäker.

övningar
- i reaktionen
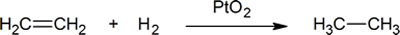
- 0,500 mol eten reagerar med _______ mol väte. Således kan en kemist säga att eten reagerar med en _______ väte.
- eten är _______; medan _ _ _ _ _ _ _ _ oxideras.
- oxidationsantalet kol i eten är________; i etan är det_______.
- när 1.000 g av en viss triglycerid (fett) behandlas med vätgas i närvaro av Adams katalysator, visar det sig att volymen vätgas som förbrukas vid 99,8 kPa och 25,0 CCC är 162 mL. Ett separat experiment indikerar att den molära massan av fettet är 914 g mol−1. Hur många kol-kol dubbelbindningar innehåller föreningen?
svar:
-
-
Visa svar
-
Visa svar
-
Visa svar
-
-
Visa Svar
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- organisk kemi med biologisk betoning av Tim Soderberg (University of Minnesota, Morris)