9.5 위반수 규칙
학습 목표
- 인식 세 가지 주요 형태의 위반의 진수 규칙이 있습니다.
옥텟 규칙이 화학 결합에있는만큼 중요하고 유용한 것처럼,잘 알려진 몇 가지 위반이 있습니다. 이것은 옥텟 규칙이 쓸모 없다는 것을 의미하지는 않습니다—아주 반대입니다. 많은 규칙과 마찬가지로 예외 또는 위반 사항이 있습니다.
옥텟 규칙에는 세 가지 위반이 있습니다. 홀수-전자 분자원자의 원자가 껍질에 홀수의 전자를 가진 분자. 옥텟 규칙에 대한 첫 번째 위반을 나타냅니다. 그것들은 거의 없지만,일부 안정한 화합물은 원자가 껍질에 홀수의 전자를 가지고있다. 홀수의 전자로,분자 내의 적어도 하나의 원자는 옥텟 규칙을 위반해야 할 것이다. 안정한 홀수-전자 분자의 예는 NO,NO2 및 ClO2 이다. 루이스 전자 dot 다이어그램을 위한 없음은 다음과 같습니다:
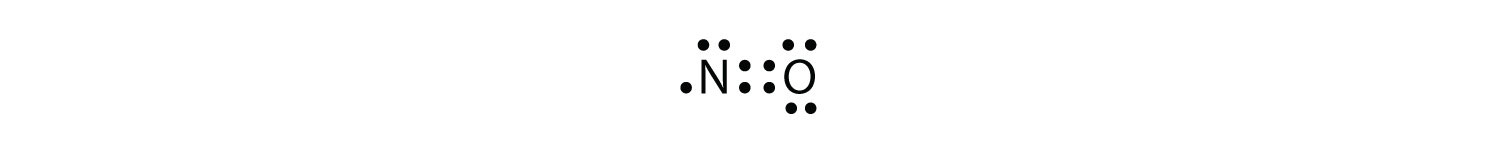
지만 오 원자가의 진수,전자,N atom 은 일곱 전자에서는 원자 쉘입니다. NO 는 안정한 화합물이지만 대부분의 다른 홀수-전자 화합물과 마찬가지로 매우 화학적으로 반응성이 있습니다.
원자의 원자가 껍질에 8 개 미만의 전자를 가진 전자 결핍 분자 분자. 옥텟 규칙에 대한 두 번째 위반을 나타냅니다. 이 안정한 화합물은 분자 내의 원자 주위에 8 개 미만의 전자를 가지고있다. 가장 일반적인 예는 베릴륨과 붕소의 공유 결합 화합물입니다. 예를 들어,베릴륨은 2 개의 공유 결합을 형성 할 수 있으며,그 결과 원자가 껍질에 4 개의 전자 만 생깁니다:
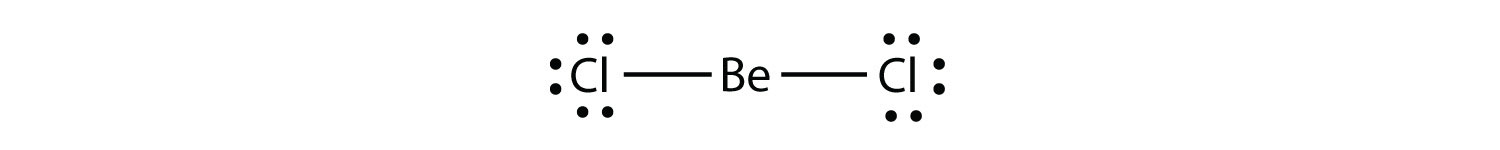
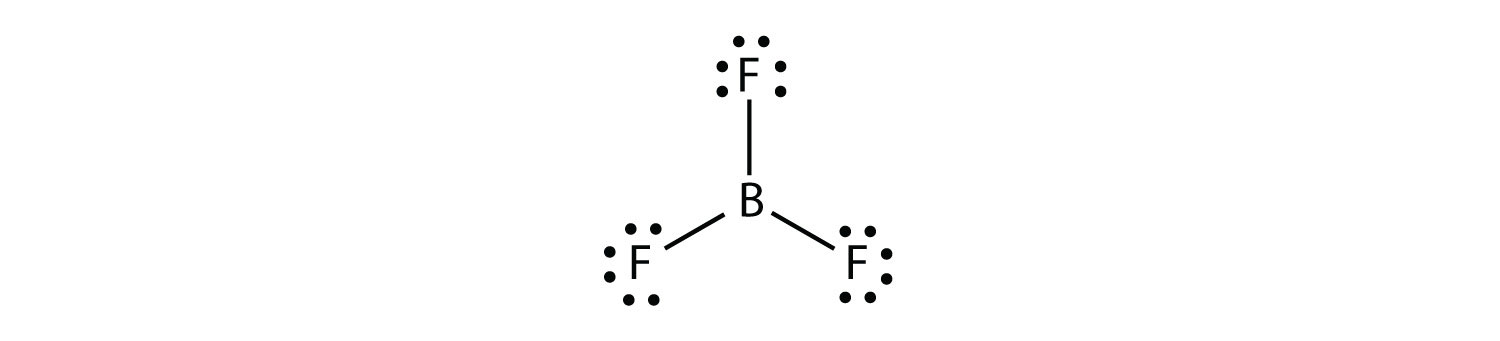
붕소는 일반적으로만 하는 세 가지 공유결합,결과에만 여섯 원자의 전자 주 B atom. 잘 알려진 예는 BF3:
세 번째 위반하수 규칙에서 발견되는 그 화합물과 함께 여덟 개 이상의 전자에 할당된 원 쉘입니다. 이들은 확장 된 원자가 껍질 분자라고합니다.원자의 원자가 껍질에 8 개 이상의 전자를 가진 분자.. 이러한 화합물에 의해 형성 중 원자들의 세 번째 행에서 주기적으로 테이블 또는 넘어 있는 빈 d orbitals 에 그들의 원자 껍질에 참여할 수 있는 공유결합니다. 그러한 화합물 중 하나는 PF5 입니다. 만 합리적인 루이스 전자 dot 다이어그램를 위한 이 화합물은 P 원자를 만드는 다섯 개의 공유결합니다.
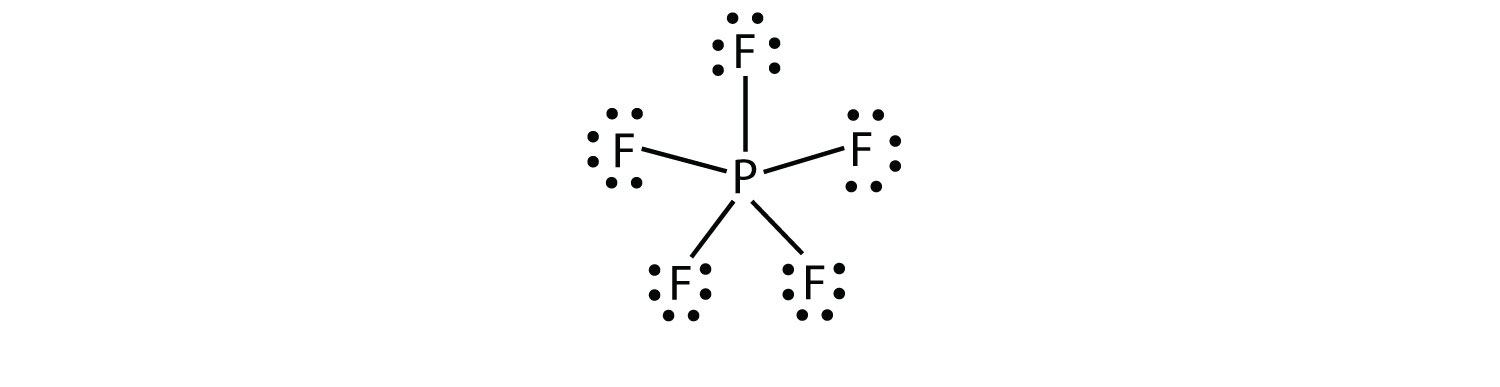
정식으로,P atom10 전자에서는 원자 쉘입니다.
실시예 9
루이스 전자 도트 다이어그램을 그려 옥텟 규칙에 대한 각각의 위반을 식별한다.
- ClO
- SF6
솔루션
-
한 Cl 원자와 하나 O atom,이 분자가 6+7=13 원자의 전자,그래서 그것은 이상한 전자 분자입니다. 루이스 전자 dot 다이어그램를 위한 이 분자 다음과 같습니다:

-
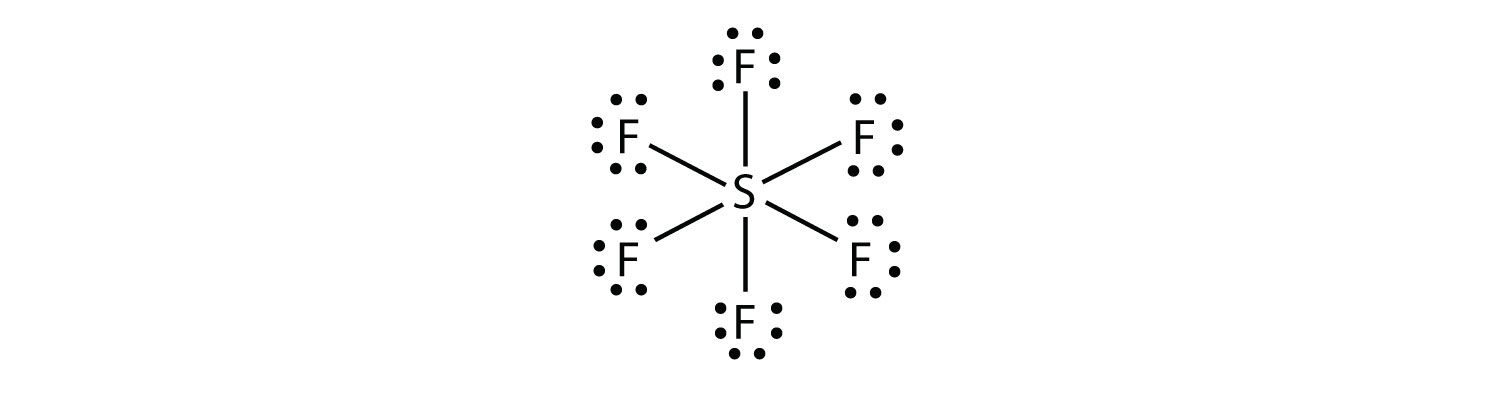
에 SF6,중앙 S atom 만드는 여섯 공유 결합하는 여섯 개의 주변 F 는 원자,그래서 그것은을 확장 원자의 껍질 분자입니다. 그 루이스 전자 도트 다이어그램은 다음과 같습니다:
자신 테스트
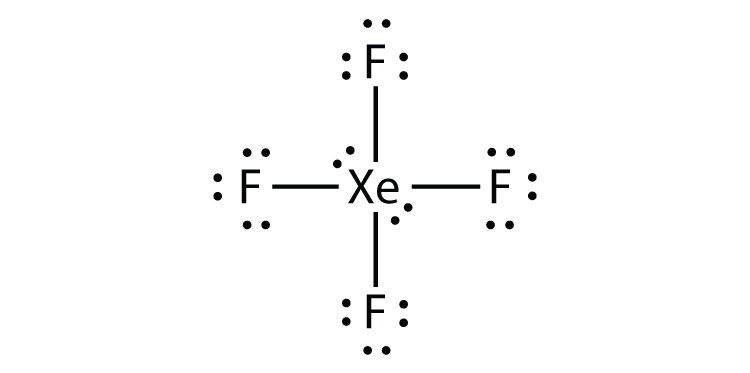
식별을 위반하수 규칙에서 XeF2 그림으로써 루이스 전자 dot 다이어그램입니다.
대답
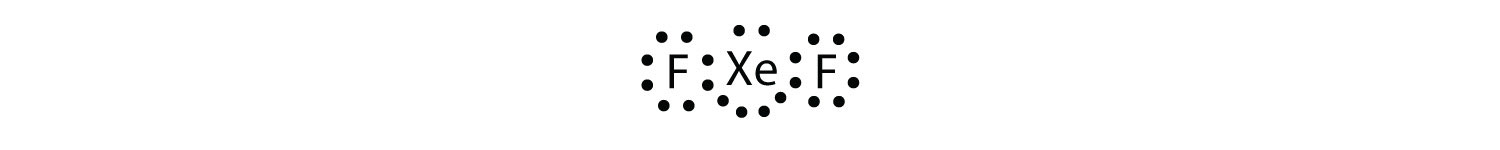
Xe 원자장 원자의 껍질과 함께 여덟 개 이상의 주위에 전자니다.
키 테이크 아웃
- 세 가지가 있 위반하수 규칙이 이상한:-전자 분자,전자는 불충분한 분자,그리고 확장한 원자의 껍질 분자.
연습
-
Why 할 수 있는 전자 분자 만족시키지 못하수 규칙?
-
Why 할 수 있는 원자 두 번째 행에서의 주기율표를 형성하지 않 확장 원자의 껍질 분자가?
-
그리기 수용 가능한 루이스 전자 dot 다이어그램을 위한 이러한 분자들을 위반하는 옥텟 규칙이 있습니다.
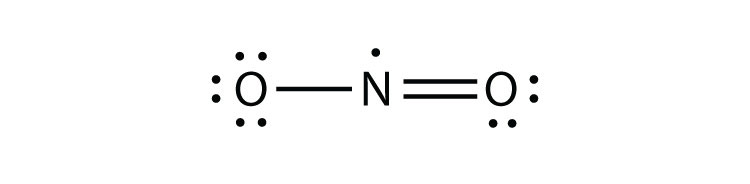
- NO2
- XeF4
-
그리기 수용 가능한 루이스 전자 dot 다이어그램을 위한 이러한 분자들을 위반하는 옥텟 규칙이 있습니다.
- BCl3
- ClO2
-
그리기 수용 가능한 루이스 전자 dot 다이어그램을 위한 이러한 분자들을 위반하는 옥텟 규칙이 있습니다.
- POF3
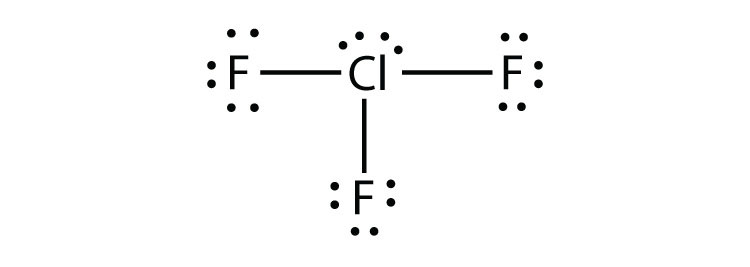
- ClF3
-
그리기 수용 가능한 루이스 전자 dot 다이어그램을 위한 이러한 분자들을 위반하는 옥텟 규칙이 있습니다.
- SF4
- BeH2
답변
-
는 방법은 없 모든 전자할 수 있습 짝이 있는 경우 이상한 그들의 숫자.
-
-
-
-