을 결정하는 특정 매개변수와 같은 크기,길이,그리고 각도에서 원자 규모가 쉽지 않습니다. 이러한 매개 변수 중 중요하기 때문에 과학자들은 원자 수준에서 매개 변수를 추론하거나 계산하는 방법을 개발했습니다. 결합 순서와 결합 길이는 한 쌍의 원자 사이의 결합의 유형과 강도를 나타내는 두 가지 중요한 매개 변수입니다.
이 기사에서는 다음과 같이 설명합니다.
1. 채권 순서와 채권 길이는 무엇입니까
2. 는 방법을 계산하기 위해 채권과 채권 길이
–을 계산하는 방법을 결합기 위해
–을 계산하는 방법 길이 채권
어떤 채권의 순서와 길이 채권
유대 길이 및 채권 있는 주문하는 두 개의 매개 변수와 관련된 공유할 수 있습니다. 유대문은 화학 결합의 사이에 두 개의 원자 및 채권의 길이는 사이의 거리를 두 원자핵는 炭 접착 함께. 이 기사에서는 원자 수준에서 결합 순서와 결합 길이를 계산하는 방법을 설명합니다.
결합 순서를 계산하는 방법
결합 순서는 두 원자 사이의 화학 결합의 수입니다. 그것은 채권의 안정성을 나타냅니다. 공유 결합에서 결합 순서는 공유 전자의 수입니다. 예를 들어 채권의 순서는 한 쌍의 원자 결합하여 단일 결합 하는 반면,채권기 위해 쌍의 원자의 결합에 의해 더블 채권은 두 가지입니다. 제로 본드 순서는 원자 사이에 결합이 없음을 나타냅니다. 분자의 안정성은 결합 순서가 증가함에 따라 증가합니다. 공명 결합을 갖는 분자는 정수 일 필요는 없다. 에서 공유기 화합물과 두 개의 원자,유대 사이의 순서는 한 쌍의 원자 첫 번째로 그리는 루이스 구조,그리고 다음의 유형을 결정권 사이에 원자 제로 채권,단일,이중 또는 삼중 결합. 예를 들어,수소 가스의 결합 순서는 다음과 같이 결정된다.
- 그리스 루이스 구조
H:H
- 의 수를 결정하는 채권/한 쌍의 원자의 전자
한 쌍의 전자,따라서이 채권 순서 1.
두 개 이상의 원자가 있으면 결합 순서는 다음과 같이 결정됩니다. 예를 참조하십시오:질산염 이온.
- 그리스 루이스 구조는
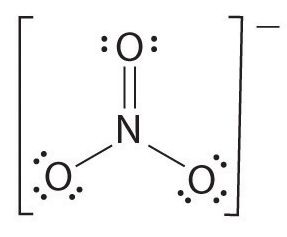
- 수의 총수는 채권(에 따라 질산이온,4)
- 의 수는 결합 그룹 사이에 개별적인 원자(에 따라 암모니아는,그것의 3 개)
- 그러므로,결합기 위해=총수의 채권/의 수는 결합 그룹
=4/3
=1.33
그러므로,결합기의 질산이온은 1 입니다.33
결합 길이를 계산하는 방법
결합 길이는 함께 공유 결합 된 원자의 두 핵 사이의 거리이다. 본드 길이는 일반적으로 0.1~0.2nm 범위입니다. 두 개의 유사한 원자가 함께 결합 될 때,결합 길이의 절반을 공유 결합 반경으로 지칭한다. 결합 길이는 두 원자의 결합 된 전자의 수 또는 결합 순서에 따라 달라집니다. 결합 순서가 높을수록 결합 길이가 짧아지는 것은 양전하를 띤 핵의 강한 당기는 힘으로 인한 것입니다. 본드 길이의 단위는 피코 미터입니다. 에서 단 하나,더블,트리플 채권,채권 길이가 길에서 순서의
트리플 본드<<싱글 채권
전기 음성을 계산하는 데 사용할 수 있습니다 유대 길이의 두 개의 원자는 다른 electronegativities. 다음의 경험적 공식은 슈 메이커와 스티븐슨이 채권 길이를 계산하기 위해 제안되었다.
dA-B=rA+rB-0.09(xA xB)
dA-B 채권 거리를 사이에 두 개의 원자 A,B,rA 및 rB 는 공유결합 반경의 A,B,
(xA xB)는 전기 음성 차이 및 B.
는 또 다른 방법을 계산하는 데 사용됩니다 대략적인 채권 길이 있습니다. 이 방법에서는 공유 결합 유형을 결정하기 위해 먼저 루이스 구조가 그려집니다. 그런 다음 Cordero 등이 수행 한 연구에 대한 차트*를 사용합니다.,및 Pyykkö 및 Atsumi,각 원자에 의해 만들어진 결합의 대응 반경이 결정된다. 그런 다음 결합 길이는 두 반경의 합계를 취하여 결정됩니다. 예를 들어,이산화탄소의 결합 길이를 결정할 때,먼저 루이스 구조가 그려진다.
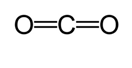
차트에 따라,공유 radius 의 탄소 이중 결합 67picometers 고의 산소 이중 결합 57picometers. 따라서 이산화탄소의 결합 길이는 약 124 피코 미터(오후 57 시+오후 67 시)입니다.
*공유 결합 차트는 여기
참고 문헌:
Cordero,Beatriz,et al. “공유 결합 반경을 다시 방문했다.”달튼 거래 21(2008):2832-2838.
Libretexts. “채권 순서와 길이.”화학 LibreTexts. Libretexts,05 12 월. 2016. 웹. 1 월 10 일. 2017.
리스터,테드,자넷 렌쇼. 고급 수준에 대한 화학 이해. N.p.:넬슨 쏜,2000. 인쇄.
Pratiyogita Darpan. “전자 구조와 관련하여 요소의 특성.”경쟁 과학 비전 8 월. 1998:엔.파그. 인쇄.
Pyykkö,Pekka,그리고 미치코 아츠미. “요소 Li-E112 에 대한 분자 이중 결합 공유 결합 반경입니다.”화학-유럽 저널 15.46(2009):12770-12779.나는 이것을 할 수 없다.