정의하고 보급
선천성 신대증(CAH)포함한 가족의 염색체 열성장애가 특징에 의해 온화한 심하게 장애인 코티솔 합성의 결핍으로 인해서 하나의 다섯 부신 steroidogenic 효소를 위해 필요한 코르티솔 생산(1,2). 전통적으로,CAH 으로 나누어 져(a)고전(CCAH)을 제시하고,소금을 낭비하거나 간단한 virilizing 는 형식은 매니페스트에서 출생 및/또는 신생아 기간에,그리고(b)가 아닌 클래식(NCCAH),을 나타내는 적게 가혹한 형태의 장애 없는 성기는 모호성,되지 않은 즉시 생명을 위협하고,선물을 나중에 생활에서,또는 유적은 증상이 없거나 잘못을 다른 질병(3). 그러나 경계에 걸쳐 다른 형태의 CAH 은 엄격하게 정의되지 않는 증가하는 경향이있는 과제와 관련된 질환입니다. 따라서 CAH 를 중증에서 경증 또는 다른 무증상으로 표현형의 연속체로 간주하는 것이 좋습니다(3).
가장 일반적인 형태의 CAH 에 의해 발생 21-hydroxylase 결핍증(21OHD),의 결과로 장애가 없거나 변환 17hydroxyprogesterone(17OHP)11deoxycortisol 및 황체 호르몬의 할 deoxycorticosterone. 봉쇄의 스테로이드 변환 결과로서 증가 생산의 안드로겐 유도체,아래 CRH-ACTH 자극 선도하는 생화학 안드로겐,에 의해 표시되는 높은 17-OHP 수준이다. 이 질병의 고전적 형태는 전 세계적으로 16,000 명의 생 출생 중 1 명에서 발생합니다. 그러나 질병의인지 된 발병률은 사용 된 스크리닝 방법과 관련이 있음을 언급해야합니다. 예를 들어,그리고 발생이의 고전적인 형태의 CAH 스웨덴에서 1:11,500 경우 설문조사 방법은 사용되는 그림이 그러나 방울을 1:9,800 때는 호르몬은 심사가 적용됩니다. 마찬가지로 프랑스와 스위스의 발병률은 다른 선별 방법이 사용될 때 1:15,472 와 1:23,000 과 1:10,749 와 1:11,661 사이입니다(4).
NCCAH 훨씬 더 빈번하고,에서 발생하는 약 1 1,000 백인과에서 더 일반적으로 특정 민족과 같은 아시케나지 유태인(1:27),스페인(1:53),Yugoslavs(1:62),그리고 이탈리아(1:300) (5, 6). 그럼에도 불구하고,데이터의 유행 NCCAH 에 따라 다른 추정 방법(케이스-설문조사,호르몬 검사,분자 테스트)부족한 부분이기도 합니다. NCCAH 는 캐리어 빈도가 1:25 에서 1:10 인 가장 흔한 상 염색체 열성 내분비 장애로 간주됩니다. 21-OHD 로 인한 NCCAH 에서 잔류 효소 활성은 약 10-70%(7-9)로 추정됩니다.
진단
에 비해의 진단적인 질병의 형태로 만드에서 출생 또는 신생아 기간 동안의 생식기 모호성 및/또는 소금을 낭비하는 증거를 통해 검사 프로그램을 채택 일부 국가에서의 대부분의 경우 NCCAH 는지 쉽게 검출(4,10). 또한,많은 개인의 증상이 남아 있는 동안 어린 시절하고 청소년기,정상적인 생식기능,만 알게 되었 NCCAH 으로의 진단 또 다른 가족 구성원과 그에 따른 테스트(11). 그러나,대부분의 여성들과 함께 NCCAH 의사의 진찰을 받으십시오할 때 경험 증상 안드로겐의 과잉하고,때 임상 의심 메시지 테스트,높은 기저 17OHP 수준보다 더 많은 가능성이 지적하지 않을 진단 NCCAH.
실제로,임상 지침서에 의해 제안된 내분비학회 추천인 기준은 비극의 값 17OHP 으로 검사 도구 NCCAH. 아침 17OHP 수준>6nmol/L 난포 단계에서 여성 생리에 메시지를 표시해야한 평가되었기 때문에 표시되는 수준의 위 6nmol/L 캡처의 90%NCCAH 인(12,13). 임의의 측정의 17OHP 되지 않은 다음과 같이 도움이 될 때문에,이러한 경우 수익률이 정상 수준을 가진 환자에서 NCCAH,그리고 그들은 또한 매우 높은 황체 단계에서의 절반이 건강한 여성이(13). 그러나 질병이있는 280 명의 피험자에서 파생 된 우리의 데이터에서 6 명의 환자(2.1%)는 기준선 17OHP 값<6nmol/L(14)을 가졌다. 또한,비데 등. 에서 큰 집단의 여성 NCCAH 에 의해 확인된 분자 기술을 또한 기초 17OHP 값보다 낮은 6nmol/L 에서는 8%를 주제의 연구(15). 마지막으로,Speiser 등이 수집 한 데이터를 기반으로합니다.,NCCAH 를 가진 개인의 9%는 2ng/ml 보다 낮은 17 개의 OHP 값을 나타냈다(6nmol/L 에 해당). 다른 연구에 따르면 5.1 과 9nmol/l 사이의 기준치 17OHP 는 NCCAH 의 진단에 충분합니다(13,16,17). 최근 4 의 기초 17OHP 수준.6nmol/L 은 유년기 동안 조기 adrenarche 를 가진 피험자에서 NCCAH 를 예측하기위한 ACTH 테스트의 임계 값으로 제안되었다(18).
이러한 발견과 제안의 합계는 Synacthen 자극 검사를받을 환자의 선택이 사례별로 평가되어야 함을 나타냅니다. 진단을 위해 3nmol/L 이상의 17OHP 후 자극 수준이 필요합니다(19). Heterozygotes 이 중 하나를 운반하는 CYP21A2 돌연변이 전시에서 약간 높은 17OHP 수준 게시 ACTH 자극지만,거기에서 겹치는 영향을 받지 않는 과목(9)입니다. 그러나,Dacou-Voutetakis 등으로. 기저 및 후 자극 17OHP 값의 합이 1.5nmol/L 을 초과하면 이형 접합성의 가능성이 예외적으로 높다고 지적했다(20).
또 다른 중요한 고려 사항은 17OHP 평가에 사용 된 기술에 관한 것입니다. 17OHP 수준을 측정하여 다양한 면역화학적 방법,그러나 최근에 표시되어,가장 정확하고 신뢰할 수 있는 결과를 달성되었으로 구현한 조합의 액체 크로마토그래피와 질량 분석(LC-MS/MS). 실제로 많은 긍정적인 거짓 17OHP 측정을 발견되었을 때 LC-MS/Ms 측정에 비해 함께 표준 방법(21)그럼에도 불구하고,후자는 절차가 있지 않은 보편적으로 사용하는 이벤트에서의 불확실한 진단을 제공할 것입니다 그들은 더 많은 정확한 결과입니다. 참고로,lc-MS/MS 정량화 된 17OHP 에 대한 스크리닝 및 진단 임계 값은 아직 정의되지 않았다. 이러한 임계값이 될 가능성이 보다 낮은 사람들과 함께 설립 immunoassays 으로 인해 강화의 특이성 LC-MS/MS,는 방법을 덜하는 경향이 상호작용 및 간섭(22,23). 최종 진단을 위해 요로 스테로이드 프로파일이 필요한지 여부는 아직 밝혀지지 않았습니다(22). 에서 경계선의 경우,그것은 권을 구하료는 부신 피질 프로파일 후 ACTH 테스트 자극을 구분 21-hydroxylase 결핍증서 효소의 결함을 진단 회사.
특별히,완벽한 스테로이드 프로필 수행해야에서는 모호한 경우를 확인 21-수산화 결핍과 제외 기타 효소를 감지. 의 포함 17OHP,코르티솔,11-deoxycorticosterone,11-deoxycortisol,17-OH-pregnenolone,데히드로,그리고돌에 안드로 스텐 디온에서 세럼 스테로이드 프로필에 유용할 것을 제외의 다른 원인 CAH 등 11β-수산화 결핍과이지 3β-hydroxysteroid dehydrogenase 부족 또는 P450oxidoreductase 부족(24). 유전자 검사는 현재 NCCAH 의 주요 진단 도구로 간주되지 않지만 진단 확인 및 유전 상담(3)에 필수적입니다.
코티솔 수치에 관한 한,일반적으로 atleast496nmol/L 의 후 자극 값이 예상됩니다. 참고로,Stoupa 등에 따르면. 의 60%47 어린이 NCCAH 의 결과로 21OHD 낮은 코르티솔 값을 자극,발견을 가리키는 필요가지 개발을 위한 신부전 중에 주요 스트레스 이벤트(25).
NCCAH 표현에서 여자
임상의 표현 NCCAH 특징으로 높은 수준의 다형성으로 문제 뿐만 아니라 나의 발병하지만 또한 다른 징후와 증상이 있다. NCCAH 의 첫 번째 임상 프리젠 테이션은 10 세 이전의 경우 11%,10 세에서 40 세 사이의 80%에 있다고보고되었습니다(12). CAH 와 NCCAH 의 유전자형-표현형 상관 관계는 아직 밝혀지지 않았다. Speiser 등. 21-하이드 록 실라 제 결핍에서의 표현형 변동성의 대부분은 전부는 아니지만 CYP21A2 의 대립 변이로부터 유래한다고 제안한다(26).
발현에서 어린 시절
에서 신생 기간,일반적으로 NCCAH 여성 증상이 남아 있고 정상적인 외부의 생식기. 보고 된 NCCAH 의 가장 초기 사례는 음모를 개발 한 6 개월 된 소녀입니다(11). 일반적으로,임상 연구 결과와 현상에 NCCAH 경우에서 시작 5 세 미만의 또는 나중에 있는 증가와 관련된 안드로겐 수준이지만,온화한 코르티솔 결핍에서도 발생할 수 있습니다 어떤 경우(8). 에서의 92%NCCAH 경우,첫 번째 증상이 나타나는 조 pubarche(PP),발생하는 8 세에서 소녀와에서 9 년에는 남자(12)예상의 유병률이 10 11.3%(15). 참고로,PP 로 언급 된 어린이의 경우,다른 연구에 따르면 NCCAH 의 발생률은 5~30%입니다(20,27). 그러나 nccah 의 분자 확인을받은 280 명의 환자에 대한 우리의 분석을 토대로,우리는 8 세 미만의 94 명의 여성에서 PP 의 발생률이 88%로 높다는 것을 발견했다. 반면에,NCCAH 를 가진 45 명의 남성에 대한 분석은 피험자의 29%에서만 PP 를 확인했습니다(14). 또한,우리는 PP 를 가진 피험자의 약 절반이 CYP21A2 돌연변이의 이형 접합체 운반체 일 수 있음을 명심해야한다.
설명이 필요한 또 다른 측면은 PP 와 조숙 한 사춘기 사이의 관계입니다. 그것은 가설에는 어떠한 경우에는,주변 방향족 신장에 가까운 안드로겐의 에스트로겐을 활성화 할 수 있습 hypothalamic-pituitary-gonadal axis,선행을 보조 조숙한 사춘기(28). 이러한 경우 정기적 인 후속 조치가 필요합니다. 일부 어린이들은 다모증,여드름 및/또는 급속한 성장을 일으키고 키가 큰 구조와 뼈 나이 발전을 나타냅니다(29). 후자는 빠른 epiphyseal 융합의 결과로 잘린 최종 높이를 초래할 수 있습니다. 다른 희귀 임상 연구 결과는 어린 시절함을 입술 접착력,주위 머리,clitoromegaly 및 쉰소리의 음성(30-32).
청소년기 및 성인 생활에서의 증상
청소년기 및 성인기 동안 여성의 NCCAH 는 다낭성 난소 증후군(PCOS)과 유사한 고 안드로겐 성 증상을 나타냅니다(33). 증상이 포함 hirsutism,여드름,안드로겐 탈모증,무배란,생리 기능 장애 및 불임. 다기관 연구에서 청소년과 성인 여성 중 가장 흔한 증상은 다모증(59%),과두 성(54%)및 여드름(33%)이었습니다. NCCAH 를 가진 161 명의 여성 중 증상을 나타내는 것은 다모증(78%),생리 기능 장애(54.7%)및 출산율 감소(12%)(34)였다. 이 질환을 가진 161 명의 여성 그룹에서 63%의 환자가 다낭성 난소 유사 표현형을 나타 냈습니다(14). 이 발견은 고 안드로겐 혈증이있는 여성에서 NCCAH 의 발병률이 높기 때문에 그 반대의 의미를 갖는다. 확실히,Witcel 등의 연구. 고 안드로겐 성 여성에서 1~33%에 이르는 NCCAH 의 발생률을보고하는 것은 큰 관심사입니다. 안드로겐 과량의 평가를 위해 언급 된 950 명의 여성에 대한 또 다른 연구에서,nccah 는 4.2%에서 검출되었다. 그러나 NCCAH 환자는 다른 그룹의 고 안드로겐 성 환자와 비교하여 더 젊고 털이 많았다. 그들은 또한 다른 고 안드로겐 성 증후군 환자보다 테스토스테론,유리 테스토스테론 및 17OHP 의 수치가 유의하게 높다는 특징이 있었다. 난소 초음파에서 77%는 다낭성 난소를,41%는 난소 크기를 증가시켰다. 요약하면,그들은 nih 와 로테르담에 따른 PCOS 기준을 각각 56%와 72.8%의 비율로 충족시켰다(35).
진보적 인 자연 질병의 강조 표시된다는 사실에 의해 다모증의 유병률이 표시되었습니다 나이가 증가 관찰되었을 드문하기 전에 사춘기. 다모증은 NCCAH 환자에서보고 된 가장 흔한 임상 증상이며 71~96%(28,36)입니다. NCCAH 를 가진 사춘기 소녀는 전형적으로 다모증으로 나타납니다(37,38). 스펙트럼의 다른 쪽 끝에는 탈모증의 문제가 있습니다. 남성 패턴 대머리는 NCCAH 환자에서보고됩니다. 탈모증의 유병률도 증가 등장으로 시대에,6%의 환자에서 동안의 두번째 십년간 그들의 생활 19%에서 다섯 번째 나타내는 다시 진보적인 자연의 질병(39). 여드름은 NCCAH 피험자의 거의 33%에서보고됩니다(36). 놀랍게도,nccah 를 일으키는 CYP21A2 유전자의 돌연변이는 심한 여드름을 가진 123 명의 성인 여성 중 4.9%에서 검출되었다(40).
oligomenorrhea 또는 이차 amenorrhea 를 포함하여 월경 불규칙은 수시로 포스트 menarche 개인에있는 NCCAH 의 제시 표시 일 수있다. 또한,8-9%의 경우도 원발성 무월경을 경험하고 이러한 이유로 처음으로 의학적 조언을 구합니다. 더욱이,NCCAH 개인들 사이에서,oligomenorrhea 는 원발성 무월경보다 더 흔합니다. 예를 들어,moran 등의 시리즈에서.,10 세에서 19 세 사이의 NCCAH 여성 중 oligomenorrhea 는 원발성 무월경이있는 청소년기의 9%에 비해 56%의 경우에 존재했습니다(12). 을 체결하는,그래서 많은 NCCAH 증상은 닮은 그들의 PCOS 는 것은 놀라운 일이 아 NCCAH 되어 있어 큰 mimicker 의 PCOS. 어떤 경우에,nccah 의 진단은 hyperandrogenic 증후를 위해 언급되는 어떤 젊은 여자의 평가 도중 고려되어야 합니다.
Arlt 등의 연구에서.,nccah 환자는 일치 된 대조군(41)과 비교하여 유의하게 높은 BMI 및 낮은 최종 높이를 특징으로했다. 이러한 데이터와 함께 몇 가지 연구를 나타내는 인슐린의 존재에 무신경,건는 불리한 대사 프로파일할 수 있는 pathophysiologically 에 의해 설명의 효과가 높은 androgen 농도 및/또는 등의 결과로 glucocorticoid 치료(42,43). 골다공증은 또한 이들 피험자에서 검출 될 수 있는데,아마도 코르티코 스테로이드 요법의 결과 일 것이다(34).
NCCAH 관리에서 첫 번째 표현하는 성인의 삶
한 번의 진단 NCCAH 설립되었습니다,여러 가지 문제에 관련된 이후의 처리를 권장 사항을 보증 고려 사항입니다. 해결해야 할 첫 번째 질문은 글루코 코르티코이드(gc)요법이 표시되는지 여부입니다. 일반적인 뒤에 이 방법을 제공하여 충분한 코르티솔 농수 환자에게,그녀의 일상적 필요를 덮여 있고,따라서 CRH-ACTH 축에 자극이 될 것입니다 가늘게 한도를 감소 부신 안드로겐 생산입니다. 일반 규칙에 관한 이러한 접근은 저 GCs 에 주어진 교과하지 않 약리학적인 복용하는 동안,의 영향,나이,성별,실험 데이터,환자,특정 권장 사항과 목표의 치료에 glucocorticoid 대체 요법을 심각하게 고려하고 있습니다. 그러나 우리는 또한 알고 있어야 하는 장기간 GC 대체 치료로 이어질 수 있습 hypercortisolemia,결과적 문서화 부작용의 모든 측면에 대한 대사 특히,성장,지방 분포,및 인슐린 저항성에서뿐만 아니라 심리학 프로필입니다. 또 다른 주요 단점은 이 방법의 부족은 충분한 임상 인덱스 또는 생화확적인 감적의 적절한 교체 투여,등에 관한 존재 TSH 값에 갑상선.
마지막으로,사실에 합의가 없는 GC 사용해야 하고 부재의 장기적인 관련 데이터에 서로 다른 형식의 GC 관리 더 복잡하게 참석한 의사 결정에서의 선택 최적의 선택을 위해 각 환자입니다. 하이드로코르티손가에서 일반적으로 사용되는 아이들,그것과 가장 유사한 천연 호르몬(cortisol)지만,그것은 고려하지 않은 적합한 접근 방식에서 청소년들과 젊은 여성에 대한 필요성으로 인해 여러 매일 투여. 따라서 대부분의 성인 내분비 학자들은 적절한 용량으로 덱사메타손 또는 프레드니솔론을 선호합니다. 다른 한편으로해야합니다,지적 동등성의 다른 Gc 를 기반으로 그들의 염증 활동과하지 않는 서로 다른 측면에서 인간을 촉진합니다. 코티솔은 인간 게놈의 거의 20%에 영향을 미치기 때문에 다양한 조직에서 다른 GCs 의 다양한 반응이 예상됩니다. 을 기울였는 이 인식이 사실의 관리 dexamethasone 을 가진 환자 CAH 과 악화의 인덱스에 있는 인슐린 저항의 비교를 다른 Gc(44). 또한,정상으로 간주되는 용량 인 프레드니솔론 2.5-7.5mg 을 투여하면 골 대사에 오랜 부정적인 영향을 미칩니다(45). 따라서 하이드로 코르티손은 GC 보충 요법의 경우 최상의 치료 형태로 간주되어야합니다. 의 출현을 새롭게 합성 하이드로코르티손식으로 한 알루고 초기에 긍정적인 결과 환자 CAH 여 많은 미래에 대한 약속이(46).
관리하는 동안 어린 시절
NCCAH 진단받은 환자들은 어린 시절 동안의 징후와 PP 으로 치료할 수 있습 하이드로코르티손의 목적으로 억제 부신 호르몬 및 방지하기 급속한 발전의 뼈대에 영향을 미칠 수 있는 최종이다. 에서 그는 환자 하이드로코르티손 치료를 시작되었다 1 년의 시작하기 전에 사춘기가 있고 뼈대는 아래 9 년,최종 고도에 남아 유전 잠재력(47). 사용할 수 있는 연구를 나타내는 성숙한 고도에 접근하는 대상에서 높이는 환자에게 가깝게 모니터링하고 사람을 엄격히 준수 약물 치료 계획(48-50). 최근의 작은 연구가 다섯 경우(환자는 6.1 9.2 세)증명하는 초저 용량의 dexamethasone 유망한 줄이기 위해 옵션을 내인성 응력 및 그것의 효과. 이것이 현실적인 접근법을 구성하는지 여부와 투여 된 투여 량이 얼마나되어야하는지는 밝혀지지 않았다(51). Nebesio 등의 연구. CCAH 를 가진 9 명의 prepubertal 환자에서 hydrocortisone,prednisolone 및 dexamethasone 의 호르몬 효력 그리고 약동학을 비교했습니다. 그들이 보여주는 dexamethasone 더 강력하는 다른 형태를 달성에서 훨씬 낮은 신장 호르몬,따라서 제안 dexamethasone 더 효능에 대해 억제 부신 안드로겐 생산(46). 물론이 발견을 확인하거나 거부하기 위해서는 추가 연구가 필요합니다. 또한,어떤 경우에는 상승 된 안드로겐 농도가 gnrh 축의 2 차 자극으로 이어져 조기 사춘기를 초래할 수 있습니다. 그와 같은 경우에는,병렬 코스 투 아날로그는 경우에 될 수 있습 뼈 나이보다 훨씬 더 높은 연령 및/또는 계획된 최종 높이는 불균형을 목표이다.
또 다른 중요한 고려사항이 관련 케이스의 수반하는 GH 결핍 이벤트에서는 치료를 투여 아날로그 및 GH 처방전에서 결과의 달성 목표(52). 에 따르면 현재 지침,앞서 설명한 치료에 조심스럽게 권장을 위한 이러한 경우에는 예상 높이 SD-2.25<대상을 높이 또는 더 낮은(53). 하이드로 코르티손 치료를 시작하기위한 대체 적응증은 부적절한 코티솔 반응 후 ACTH 자극(36)입니다.
소아에서 선호되는 GC 치료법은 일반적으로 하이드로 코르티손 10-15mg/m2 이며 3 가지 용량으로 나누어집니다. 종종 6mg/m2/day(34)부터 시작하여 더 낮은 용량으로도 효과가 입증되었습니다. 과량 투여는 가난한 성장뿐만 아니라 쿠션성 특징을 초래할 수 있다는 점을 고려하여 피해야 한다. 일반 성장 패턴,뼈 나이 호환되는 연령,그리고 중앙의 부재로 비만으로서의 역할을 할 수도 있 임상 지수 위해 적절한 관리합니다. 에 대한 생화학/호르몬,프로필돌에 안드로 스텐 디온 및 테스토스테론 레벨에서 중 상위 범위에 대한 뼈대는 더 나은 것으로 간주됩 마커의 적절한 GC 교환 치료에서 아이들과 함께 NCCAH. 그러나,억제 테스토스테론 레벨에서 발견되었의 10%NCCAH 환자는 반면,다른 28%의 환자는 증가했 테스토스테론 농도,이 현상 가능성에 귀속되는 히드로코르티손 가변성(54,55). DHEAS 값은 감소로 매우 작은 용량는 반면,억제의 17OHP 및 황체 호르몬 수준을 필요가 매우 높은 GC 복용합니다. 17OHP 값은 진단에 결정적이지만 추적 관찰 중에는 도움이되지 않는다는 점에 유의해야합니다. 참고로,호르몬 평가를위한 혈액 샘플링은 치료를 중단하지 않고 수행되어야합니다. 그러나,당시의 질병과의 다각적인 자연,거기에 특정한 지침에 대한 타이밍의 처방에 변경 또는 중단 glucocorticoid 치료에서 아이들이다.
관리하는 동안 청소년기
치료 환자 어린 시절부터
까지의 설립은 정상적인 생리에서 패턴을 NCCAH 여자의 지속 GCs 시작한 어린 시절은 매우 좋(56). 그러나 청소년 환자는 자주 보이지 않는 충분한 준수를 만성 약물의 종종 생략하량에 있습니다. 또한,사춘기 동안의 하이드로 인하여 50%의 결과로서 증가 IGF-1 수준을 감소 11ßOHSD 활동뿐만 아니라,증가로 인해 코르티솔 정리에 따른 증폭의 사 여과율(57). 젊은 여성,2 년 초경 경우 정상적인 치료 사이클 기록되어 있어,환자 중심의 접근 방식으로 hyperandrogenic 할 수 있는 현상은 나타나는 것이 좋습니다.
다모증,여드름 및/또는 oligomenorrhea 와 같은 심각한 hyperandrogenic 소견이있는 경우 치료의 지속이 고려 될 것입니다. 고 안드로겐증의”구충제”징후에 의해 심각하게 손상 될 젊은 청소년의 연약한 감성을 기억하는 것이 중요합니다. 고 안드로겐 성 징후,생리 장애 및 삶의 질 저하의 조합은 잘 문서화되어 있으며 젊은 여성에서 특히 높습니다. 고려해야 할 또 다른 요점은 부신 예비 후 ACTH 자극의 반응입니다. 는 피크 코티솔의 pubertal 고 성숙한 여성 후에 자극은 아래 496nmol/L,의 케이스에서 스트레스,스테로이드 치료를 투여해야 한다(58). 다른 한편으로는 경우에,위의 증상에서 발생하는 젊은 환자,GC 처리를 중단될 수 있습한 후,정규 follow-up 이 좋습니다.
여성으로 먼저 표현하는 동안 청소년기 또는 Hyperandrogenic 후 증상 치료 중단
에서 존재의 hyperandrogenic 증상,환자 중심의 접근 방식은 매우,추천에 초점을 맞추고 주의 불만 환자입니다. 이보다 훨씬 더 나은 일반적인 보편적인 수법이기 때문에,후자의 접근 방식,젊은 환자 실망하게 될 것입,이를 선도하는 처리를 중단하고,그 결과로 건강에 부정적인 결과를 성인. 는 경우에는 심한 hirsutism,코스의 6~12 개월 동안 경구 피임약(OCPs)구성하는 합리적인 절차의 유익한 효과 OCPs 에 SHBG 간 생산 및 감소로 다른 스테로이드 호르몬 릴리스에서는 난소입니다. 임상 개선될 것이 예상되는 다음에 적어도 2~3 개월의 OCPs 시작하면서,동시 사용의 progestagen 최소화하겐 속성이 매우 좋습니다. 는 경우 OCPs 실패로 첫 번째 라인 접근 방식,antiandrogens(spironolactone,flutamide,바이칼 루타 미드,cyproterone 아세테이트,그리고 finasteride)가 추가될 수 있습니다. 저희의 경험 관리의 바이칼 루타 미드 달성에 상당한 개선이 심한 경우 여드름,하지만 비슷한 결과를 얻지 못하였을 경우에는 심한 hirsutism. 화장품 접근 방식 같은 레이저 응용 프로그램 및 depilatories 할 수 있는 권할 수도한 여자의 불평은 과도한 또는 원치 않는 머리카락의 성장 또는 두피의 머리 손실(안드로겐 탈모증)(32,34,57).
자극 후 코티솔 분비가 불충분 한 환자 또는 Ocp 및 항 안드로겐을 용인 할 수없는 경우 GCs 를 사용한 코스를 적극 권장합니다(57). 새로운 등의 데이터. 을 나타내는 불규칙한 경고 여드름이 반전 3 개월 이내에 개시 후 glucocorticoid 치료는 반면,다모증이 필요 거의 30 개월(59)입니다. 어린 시절과 달리 청소년기에는 더 오래 작용하는 스테로이드가 종종 사용되며 프레드니솔론 5mg 또는 덱사메타손 0.25mg 의식이 요법이 권장됩니다(53). 그러나 현실 세계에서 임상 데이터는 NCCAH 관리에 적용된 다양한 다른 요법을 보여주었습니다(41).치료의 주요 목표는 고 안드로겐 성 증상으로부터 환자의 완화 여야합니다. 따라서,개인들 사이에서 가 NCCAH 진단을 기반으로 실험 결과,임상 기능을 가이드 management 권장 사항 때문에,호르몬 및 분자 연구 결과하지 않는 반드시 예측 임상 시험을 추가합니다. 내분비 학회 지침에 따르면 nccah 환자에게는 증상이 해결 될 때 GC 치료를 중단 할 수있는 옵션이 주어져야합니다(60). 물론,이 환자들은 추적 관찰을 잃어서는 안되며,증상이 재발하는 경우 치료를 다시 시작해야합니다. 또한,의 경우 중단,환자에 대한 정보를 수 있는 가능성의 불임 및 격려해야하는 의학적인 조언을 구하면 그들이 원하는 임신(19). 의 참고,적절한 전송에서 환자의 소아과 성인 내분비를 실시해야한다,최적으로 1 년 후의 동기화 모니터링(53,61).
NCCAH 및 재생
처를 만드
처를 만드는 것입니다.일반적으로 보고서는 고전적인 형태의 CAH,주로 기인하는 생리 질환,만성 무배란,그리고 해부한다. 출생률은 대조군(62)의 65%에 비해 17%로 추산되었습니다. 한편,데이터에 대한 여성의 불임과 NCCAH 최근에 평가에서 세부사항 및 예상되는 불모 발생률 11%사이에서 NCCAH 여자,즉,비교적 온화한다에서 CAH 며,많은 경우에는 쉽게 해결됩니다. 비데 등. NCCAH 를 앓고있는 190 명의 여성에서 불임을 평가했으며 그 중 95 명은 임신하기를 원했습니다. 이 인구에서 85 명의 여성에서 187 건의 임신이보고되었으며,이로 인해 82 명의 개인에서 141 건의 출생이 발생했습니다. 그것을 강조해야 하는 99 의 임신(52.9%)이전에 발생한 진단의 NCCAH,세 개의 그들의 응용 프로그램과 함께 배란 유도 프로토콜,나머지는 자발적하는 동안,88 임신했다는 장소 포 NCCAH 진단입니다. 의 대부분에서 그들에게 임신을 개발한 후에는 기관의 치료로 하이드로코르티손,반면에서 11 명의 여성 그것은 일이 자발적으로(63,64). 임신을 원하는 22 명의 관찰 된 NCCAH 여성의 또 다른 보고서에서 프레드니손(65)과 함께 12 건의 임신이 계속되었다.
유산
비데 등의 코호트에서. 유산 율은 gcs 로 치료받은 환자와 치료받지 않은 환자에서 각각 6.5 와 26.3%였다(64). 결과 임신의 수도 성공할 수 없는 glucocorticoid treatment 경우에는 NCCAH 아직,진단에도 사례 보고서에 의해 Cuhaci et al. 그럼에도 불구하고,같은 부부는 두 번의 유산을 경험했으며이 첫 임신(66)이후에 하위 임신을보고했습니다. Bidet et al.에 의해 평가 된 바와 같이,조산 임신의 가능성에 관한 한. 나머지 인구(15)와 크게 다르지 않습니다.
출산 계획
그 여자를 위한 증상 안드로겐 또는 보고 불모지만하고자하는 임신,GC 치료는 매우 좋습니다. 이 기간 동안 사용 된 글루코 코르티코이드는 프레드니손 또는 하이드로 코르티손입니다. 후속 단계를 안내 할 것이기 때문에 가장 중요한 조치는 예비 부모의 유전자 검사입니다. 임신을 원하는 NCCAH 를 가진 여성은 질병의 고전적 형태를 가진 유아를 낳을 위험을 알고 있어야합니다. 의 결과 임신 중에서 여성으로 NCCAH,그리고 더 구체적으로의 발생으로 태어난 유아 CCAH,추정된 최근의 연구에 사이 1.5 2.5%NCCAH 에서 약 15%(36,64). 물론이 빈도는 기준 인구에 따라 다르며,근친 결혼 비율이 높은 인구에서 발생하는 발생률이 더 높습니다(36). 예상의 기회를 부모가 아이를 낳으로 CAH1 120 에서 알 수없는 아버지의 유전자로하는 경우 아버지는 아무 관련 돌연변이,1 에서 4 만약 그가 이형 돌연변이(19). 결과적으로,유전자 테스트 파트너가 이러한 여성의 필수적 위험 평가 아이를 낳으로 고전적인 형태의 CAH(64,67).
경우에는 장래의 어머니는 NC 돌연변이(Table1),거기에 절대적인에 필요한 유전자 테스트 장래에 아버지 때문에,그 경우 heterozygous 에 대한 CYP12A2 돌연변이,자식에서 위험의 개발을 비고전적 질병의 형태다. 그러나 캐리어 상태는 다른 개체군에서 2-15%이며이 개체군의 절반이 심각한 돌연변이를 가지고 있음을 유의해야합니다. 또한 최종적인 권장 사항에 관한 상황을 때 유전자 테스트는 필요하지 않습은 어려운 부여 불완전한 유전자 형 상호 관계,특히 온화한 돌연변이가 있습니다. 예를 들어,NCCAH 와 가장 빈번하게 관련된 P30L 돌연변이는 고전 CAH 환자에서도 발생합니다. 대규모 다기관 유럽 연구에 따르면 최근 78%의 환자에서이 사례가 나타났습니다. 이 연구에서 경미한 V218L 돌연변이는 30%의 경우에서 Nccah 가 아닌 고전과 관련이 있었다. 따라서 NCCAH 를 가진 모든 환자는 유전 상담과 생식 파트너의 분자 평가를 제공해야합니다.
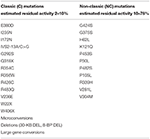
표 1. 최소(C)또는 중간(NC)잔류 효소 활성을 갖는 CYP21A2 의 돌연변이(14,68,69).
대조적으로,이벤트에서는 장래의 어머니는 화합물 heterozygote 하나의 심(C)and one NC 돌연변이,그 유전자 테스트의 미래에 아버지가 필수적입니다. 우리가 염두에 두어야 하는 데이터에서 발생하는 연구를 사용하여 immunoassays 나 더 정확한 LC-MS/MS 절차,일관되게 강조하는 무능력 안정적으로 제외 heterozygosity 를 사용하여 기초 또는 ACTH 자극 17OHP 값으로 인해 중요한 중복으로 정상적인 범위입니다. 하나의 사용을 권할 수 있습니 Synacthen 테스트,그렇지 않은 경우 호환 heterozygosity(의 합계 기초과 첨단 자극 17OHP 값<1.5nmol/L),다음 DNA 테스트를 피할 수 있습니다. 그러나 우리는 다른 연구에서 검증되지 않았기 때문에이 시험의 해석에 매우 신중해야합니다. 따라서,사용 ACTH 자극 21-deoxycortisol 중 유일하게 또는 부분의 스테로이드 비율 또는 스테로이드 프로파일 수 있습을 촉진하는 생화학의 식별 heterozygotes 이후에,특히 같은 LC-MS/MS 더 널리 사용할 수 있습니다. 장래 아버지가 NC 돌연변이를 가지고 있다면 다른 것은 필요하지 않습니다. 반대로,그가 고전적 돌연변이의 운반체라면,태아의 산전 치료에 관한 질문이 생길 것입니다. 가능한 모든 유전자형 조합과 제안 된 절차가 표 2 에 제시되어있다.

표 2. 미래의 부모 유전자형에 따라 임신 중에 제안 된 절차의 계획.
태아 치료의 CAH
목적의 태아 치료의 CAH 예방의 생식기 남성화 태아의이지만,또한 퇴치의 느끼는 스트레스에 의해 부모님들이 자녀와 모호한 성 기(70). Dexamethasone 사용할 수 있는 기능 때문에 십자가 태반과하지 않기 때문에 비활성화에서 태반 11β 오 효소 스테로이드 및 결합이 최소한으로만 어머니의 피티딩 글로불린(CBG). Dexamethasone 는,태아 ACTH 분비를 억압해서,높은 태아 안드로겐 생산을 감소시킵니다. 핵형 또는 DNA 분석이 각각 남성 또는 영향을받지 않는 여성을 드러내는 경우 치료를 중단해야합니다(71). 그럼에도 불구하고 있지만,태아의 생식기 남성화는 이미 시작되었에 6~7 주시는 개념,융 융모 생체검사를 위한 유전자 진단 얻을 수 없습니다 전에 제 10−12 주입니다. 이 시간 간격을 제안하는 모든 임신을 위험에 대한 virilizing CAH 처리해야 하지만 1 만 8 태아가 영향을 받는 여성(19,34,70).
지 이 노출의 태아를 dexamethasone 를 위한 예방적 조치를 의학적으로 윤리적으로 허용되는 논란이 남아 있(70). 동물의 연구 결과는 첫 번째 임 dexamethasone 감소는 출생에 영향을 미친 신장 pancreatic beta 세포의 기능과 두뇌 개발,그리고 걸리기는 불안,고혈압,혈당에서 성인(70). 또한,10-20%의 임신한 여자를 사용하여 dexamethasone 처리 임신 중 불의 체중 증가,증가 식욕,조울증,불면증,부종,고혈압,혈당,그리고 가는 줄. 그러나,새로운 등. 태아기에 덱사메타손으로 치료 한 태아에서 평균 Prader 점수보다 낮은 것으로 밝혀졌지만 장기 결과에는 차이가 없었다(72). 또한,Merce Fernandez-Balsells 등의 리뷰에서.,덱사메타손은 유의 한 모체 또는 태아 역효과없이 태아 virilization 의 감소와 관련이있는 것으로 나타났다(63). 그러나 저자 기술 검토 뿐 아니라 연속적인 지침의 내분비학회는 점 때문에 작은 샘플 크기에 몸 전체의 문학 주제를 불확실 및 추가 조사를 명확하게 필요하다.
에 대한 결정을 시작한 치료만 받아서는 큰 센터와 경험있는 팀 프로토콜 승인된 기관에 의해 검토가 보드를 기반으로 가족의 가치하고 기본 설정과 그들의 서면 동의 전제 조건으로(월 19 일,63). 여러 가지 전문가가 현장에서 나타내는 더 높은 값을 배치해야에 방지하기는 불필요한 태아의 노출은 어머니 태아 dexamethasone 강요하기보다는 감정적인 수신자의 모호한 생식기 부모와 환자입니다. 가장 중요한 것은,그것을 명확히 해야하는 부모 dexamethasone 관리 수정하지 않은 환자 상태이지만 향해 필요를 감소에 대한 수술이 아닌 생명을 보존 또는 지적 능력이다. 그들은 또한 치료에도 불구하고 자녀가 질병의 고전적 형태로 고통받을 확률이 높다는 것을 알아야합니다. 가장 결정적으로,그 사이에,노출의 젊은 생물체에게 매우 강력한 GC 동안 특히 민감한 기간은 태아의 프로그래밍과 성장을 잘 쓸모없는 증명서의 경우 태아와 XY karyotype,은 현재 지원하는 강력하고 나무랄 데이터입니다.
이 있어야한 조기 진단,이를 통해 수행하는 비침범성 기술의 시작하기 전에 남성화 생식기의 태어날 수 있습니다. 에서 작업하는 이 방향으로,새로운 연구에 포인트를 사용하여 세포의 자유로운 태아 DNA 에서 얻은 모성 플라즈마으로 유망한 방법을 할 수 있도록 결정의 태아 성과의 진단 CAH 초기 임신 나이(<9 주이다). 이 절차가 임상 실습에서 널리 시행되면 불필요한 태아기 덱사메타손 치료를 피할 수 있습니다(73).
치료에 임신 중
임신,여성 NCCAH 어야 바람직하게 처리 될 것으로 하이드로코르티손 뿐만 아니라,때문에 임신은 일반적으로 동반해 높은 스트레스 수준이지만,도에 대한 예방 조치로 결의 높은 발생률의 유산. 이 양식의 glucocorticoid 이 선호하는 때문에 대사에 의해 태 반 효소 11β OH 스테로이드 dehydrogenase II,을 방지하는 glucocorticoid 에서 어떤 영향을 미치에서 태아(71). 에서의 시간이 임신,히드로코르티손이 복용량이 증가해야 한다 20~25mg/day 복용량과 수정을 수행되는 모든 6-8 주는 목적을 유지하는 테스토스테론 수치에서 상단 정상적인 수준의 임신 임신(74). 예를 들어,두 명의 건강한 쌍둥이를 임신 한 후 3 년까지 NCCAH 를 가진 환자의 테스토스테론 및 D4 값이 표시됩니다(그림 1).
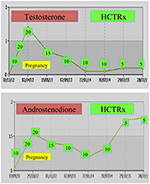
그림 1. 테스토스테론과 andostenedione 수준 및 연속적인 hydrocortisone 투약(HCTRx),개념에서 nccah 를 가진 환자에게 관리된 3 년 포스트 납품까지.
기타 특별한 문제
스트레스 관리에 NCCAH
동안 중요한 생명을 위협하는 스트레스,수술,또는 심각한 질병에 환자 NCCAH 는 glucocorticoid-로 치료가 필요할 수 있습 크게 또는 더 자주 용량의 스테로이드제제 부여하는 자신의 신 기능 iatrogenically 되지 않습니다. 이를 위해서 교육하면 부모가 어린 아이의,뿐 아니라 다시 교육을 환자에 자신의 전환인 관리,스트레스에 대한 투여. GCs 로 치료하지 않거나 중단시 NCCAH 환자의 경우 ACTH 에 대한 코티솔 반응을 평가해야합니다. NCCAH 환자의 거의 1/3 이 자극에 부적절하게 반응합니다(15,75). ACTH 자극에 정상적으로 반응하는 사람들에게는 스트레스 용량으로 치료하지 않는 것이 좋습니다(19). 염류 코르티코이드 치료는 필요하지 않은 경우에,이들 환자는 정상적인 호르몬 분비하고 개발하지 않는 소금을 낭비(58). 의 참고의 경우,갑상선기능항진증 또는 증가를 많이 치료,코르티솔 허가 증가와 신장에 가까운 위기가 발생할 수 있습니다(58,76).
Nccah 에서의 정신 생물학적 측면
Meyer-Bahlburg et al. 여러 연구에서 21OH 결핍으로 인해 NCCAH 환자 중 손상된 심리적 프로파일을보고했습니다. 좀 더 구체적으로 영향을 받는 여성이 높은 남성화/defeminization 점수에 몇 가지 조치의 성별에 관련된 행동과 비교할 때 정상적인 통제 여성,하지만 크게보다는 여성에서 고전 CAH. 그들은 또한 양성애자 또는 동성애 지향이 크게 증가했습니다. 회고전 임상 성적과의 인터뷰는 이러한 여성의 역사를 밝혀 불편함과 사회적 스트레스 관련의 사전 치료 경험을 가진 안드로겐 의존하는 표시,등 여드름,hirsutism,그 개념은 어려움(59,77,78). 마찬가지로,Arlt 등. 나타났다는 주관적인 상태를 크게 장애인이 모든 여덟 도메인의 단기적인 건강,설문 조사와의 가장 눈에 띄는 차이와 비교되는 연령 및 성 일치 컨트롤과 관련한 도메인의 일반적인 건강,활력 및 역할으로 인해 제한 감정적인 문제입니다. 병원 불안 및 우울증 척도(Hads)설문지는 또한 불안 점수가 증가한 것으로 나타났습니다(41). 베어링 마음에서 이러한 연구 결과,심리적 매개 변수를 안내하는 치료는 고려되어야에서 여성으로 NCCAH 고의 컨텍스트에서 환자 중심의 접근 방식은,심리 진단하고 지원해야하 제공합니다.
결론
NCCAH 는 20-50%효소 활성의 유지 때문에 CAH 의 더 빈번하고 온화한 형태로 간주됩니다. 대부분의 환자는 안드로겐 초과와 관련된 증상으로 인해 삶의 어느 단계에서나 의학적 조언을 구할 수 있습니다. 이러한 조 pubarche,빠른 성장,hirsutism,여드름,생리 부정 또는 불모뿐만 아니라 많은 다른 눈에 띄는 표현이다. 이른 아침에 초기 값의 17OHP 로 좋은 초기 심사 테스트와 추가적인 평가와 함께 ACTH 자극과의 경우,경계선한 결과,유전자 테스트하는 것이 좋습니다. 일반적으로 androstenedione 과 17OHP 수준이 아닌 후속 조치 중에 사용해야합니다.치료 결정은 사실에 대한 평가를 기반으로해야하며 개별화 된 접근법을 따라야합니다. 치료되지 않은 항상 표시면 환자가 증상,예를 들어,어린이 발병 초기고 급속한 발전의 음모하고 몸 머리,빠른 성장,그리고/또는 골격이 발전하는 여자와 oligomenorrhea,여드름,hirsutism,불임,또는 이들의 조합하고 다른 사람의 상기 증상입니다. 유전 상담은 아버지의 유전자형뿐만 아니라 임신을 원하는 NCCAH 여성에게 강력히 권고됩니다. 전반적인 관리 환자의 또한 관리를 포함한 가능한 합병증의 glucocorticoid 치료 또는 대사 관련 질병의 발현. 마지막으로,주어지는 많은 치료와 관련된 문제가 적절한 관리의 이러한 환자가하지 않았습니다,그것은 매우 중요한에 대해 담당 의사를 최신 상태로 유지 모두 개발이 분야에서 통합으로 새로운 데이터를 자신의 임상습니다. 확실히이 분야의 추가 임상 연구가 필수적입니다.
을 대 NCCAH 여자,이상적인 접근 방식은 맞춤형 중 하나를 통합,매끄러운 전환의 그녀의 관리를 한 번 그녀는 언급에서 소아과 성인 내분비,와 함께 증상이 지향적 처리하는 것이 그녀를 동반에 걸쳐 그녀의 삶입니다. 주어진 여러에 영향을 미치는 요인 hyperandrogenic 시스템는 것이 좋습을 격려하는 환자를 채택하는 건강한 라이프 스타일을 개선하여 그들의 식생활,운동을 증가시키고를 목표로 체중 감소입니다. 또한,어떤 경우에는 심리적 지원이 종종 유익합니다. 또한,에서 전문가 분야에 관련된 치료의 장애 등 피부과,산부인과,심리학자에 필요-깊이 이해 관리에 대해 의심스럽거나 이미 경우 진단의 NCCAH. 을 체결하는,저희에게 유지 하는 마음에서 견적 통찰력이 있는 미국의 천문학자 Vera Cooper 루빈:”과학 진행할 때 가장 관리에 힘을 변경하는 우리의 선입견을 없애줍니다.”
저자는 기여금
나열된 모든 저자가 만든 실질적,직접적이고 지적인 공헌하는 작업,그리고 승인에 대한 출판물이다.
이해의 충돌 문
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.나는 이것이 내가 할 수있는 유일한 방법이라고 생각한다. Speiser PW,흰색 PC. 선천성 부신 과형성. N Engl J 의대. (2003) 349:776–88. doi:10.1056/NEJMra021561
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
2. Turcu AF,Auchus RJ. Adrenal steroidogenesis and congenital adrenal hyperplasia. Endocrinol Metab Clin North Am. (2015) 44:275–96. doi: 10.1016/j.ecl.2015.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Speiser PW. Nonclassic adrenal hyperplasia. Rev Endocr Metab Disord. (2009) 10:77–82. doi: 10.1007/s11154-008-9097-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Gidlöf S,Falhammar H,Thilén A,von Döbeln U,Ritzén M,Wedell A,et al. 스웨덴의 선천성 부신 과형성 100 년:회고 적,인구 기반 코호트 연구. 란셋 당뇨병 내분비. (2013) 1:35–42. doi:10.1016/S2213-8587(13)70007-X
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
5. Speiser PW,듀폰 B,루빈스타인 P,광장 A,Kastelan A,새로운 MI. 비 고전 스테로이드 21-하이드 록실 라제 결핍의 빈도가 높습니다. Am J Hum Genet. (1985) 37:650–67.
PubMed Abstract | Google Scholar
6. Wilson RC, Nimkarn S, Dumic M, Obeid J, Azar MR, Azar M, et al. Ethnic-specific distribution of mutations in 716 patients with congenital adrenal hyperplasia owing to 21-hydroxylase deficiency. Mol Genet Metab. (2007) 90:414–21. doi: 10.1016/j.ymgme.2006.12.005
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Miller WL. Clinical review 54: genetics, diagnosis, and management of 21-hydroxylase deficiency. J Clin Endocrinol Metab. (1994) 78:241–6. doi: 10.1210/jcem.78.2.8106606
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Witchel SF, Azziz R. Nonclassic congenital adrenal hyperplasia. Int J Pediatr Endocrinol. (2010) 2010:625105. doi: 10.1186/1687-9856-2010-625105
PubMed Abstract | CrossRef Full Text | Google Scholar
9. 윌슨 RC,메르 카도 AB,쳉 KC,새로운 MI. 스테로이드 21-히드 록 실라 제 결핍:유전자형은 표현형을 예측하지 못할 수 있습니다. J Clin Endocrinol Metab. (1995) 80:2322–9. 도이:10.1210/jc.80.8.2322
CrossRef 전체 텍스트|Google 학술검색
10. 화이트 PC. 선천성 부신 과형성에 대한 신생아 선별 검사. 냇 레브 내분비. (2009) 5:490–8. 도이:10.1038/nrendo.2009.148
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Kohn B, Levine LS, Pollack MS, Pang S, Lorenzen F, Levy D, et al. Late-onset steroid 21-hydroxylase deficiency: a variant of classical congenital adrenal hyperplasia. J Clin Endocrinol Metab. (1982) 55:817–27. doi: 10.1210/jcem-55-5-817
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Moran C,Azziz R,Carmina E,Dewailly D,Fruzzetti F,Ibañez L,et al. 21-하이드 록실 라제 결핍 성 비 고전적 부신 과형성은 진행성 장애:다기관 연구. Am J 산부인과 Gynecol. (2000) 183:1468–74. 도이:10.1067/폭도.2000.108020
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
13. Azziz R,Hincapie LA,Knochenhauer ES,Dewailly D,Fox L,부츠 LR. 고 안드로겐 성 여성 중 21-하이드 록시 라제 결핍 성 비 고전적 부신 과형성에 대한 스크리닝:전향 적 연구. 페르 틸 스테 릴. (1999) 72:915–25. doi:10.1016/S0015-0282(99)00383-0
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
14. Livadas S,Dracopoulou M,Dastamani A,Sertedaki A,Maniati-Christidi M,Magiakou A-M,외. 스펙트럼의 임상,호르몬 및 분자 연구 결과 280 개인과,비 고전 선천성 부신 증식에 의해 발생의 돌연변이 CYP21A2 유전자입니다. Clin Endocrinol(Oxf). (2015) 82:543–9. 도이:10.1111/cen.12543
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
15. 비데 M,Bellanné-Chantelot C,Galand-Portier M-B,Tardy V,Billaud L,Laborde K,외. 임상 및 분자 특성의 집단의 161 관련이 없는 여성들과 함께,비 고전 선천성 부신 증식로 인하여 21-수산화 결핍과 330 가족들이 있습니다. J Clin Endocrinol Metab. (2009) 94:1570–8. 도이:10.1210/jc.2008-1582
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
16. Escobar-Morreale HF,Sanchón R,San Millán JL. 고 안드로겐 성 증상 및 징후로 나타나는 여성들 사이에서 비 고전적 선천성 부신 과형성의 유병률에 대한 전향 적 연구. J Clin Endocrinol Metab. (2008) 93:527–33. 도이:10.1210/jc.2007-2053
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
17. Dewailly D,Vantyghem-Haudiquet MC,Sainsard C,Buvat J,Cappoen JP,Ardaens K,외. 후기 발병 21-하이드 록 실라 제 결핍에서의 임상 적 및 생물학적 표현형. J Clin Endocrinol Metab. (1986) 63:418–23. doi:10.1210/jcem-63-2-418
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
18. Gönç EN,Ozön ZA,Alikaşifoglu A,Engiz O,Bulum B,Kandemir N.(2011). 기저 혈청 17-OH 프로게스테론은 조기 아드레날린에서 비 고전적 선천성 부신 과형성을 예측하는 신뢰할 수있는 매개 변수입니까? 터크 J 소아과. 53:274–80.
PubMed Abstract/Google Scholar
19. Speiser PW,Azziz R,Baskin LS,Ghizzoni L,Hensle TW,Merke DP,외. 스테로이드 21-하이드 록 실라 제 결핍으로 인한 선천성 부신 과형성:내분비 학회 임상 실습 지침. J Clin Endocrinol Metab. (2010) 95:4133–60. 도이:10.1210/jc.2009-2631
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Dacou-Voutetakis C, Dracopoulou M. High incidence of molecular defects of the CYP21 gene in patients with premature adrenarche. J Clin Endocrinol Metab. (1999) 84:1570–4. doi: 10.1210/jc.84.5.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Ambroziak U,Kepczynska-Events I,Kurylowicz,Małunowicz EM,Wójcicka,Miskiewicz P,et al. 의 진단 nonclassic 선천성 증식의 부신 피질로 인하여 21-hydroxylase 결핍을 기반으로,혈청 기초 또는 포스트-ACTH 자극 17-hydroxyprogesterone,이어질 수 있습니다 긍정 진단입니다. Clin Endocrinol(Oxf). (2016) 84:23–9. doi:10.1111/price12935
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
22. Ambroziak Y,Kepczynska-Events I,Kurylowicz,Wysłouch-Cieszyńska A,Małunowicz EM,Bartoszewicz,et al. LC-MS/MS 는 21-hydroxylase 결핍에 대한 스크리닝을 향상시킵니다. Gynecol 내분비. (2015) 31:296–300. doi:10.3109/09513590.2014.994599
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
23. bbc,CC,골드만 MM,장 K,클라크-N,Reitz 재 Welt CK. 동시 측정의 스테로이드 호르몬을 가진 여성에서 증후군,다낭성 난소 제어 사용하는 여성 액체 크로마토그래피-탠덤 질량 분석. PLoS 하나. (2014)9:e93805. doi:10.1371/저널.폰.0093805
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
24. 레이 JA,Kushnir MM,Yost RA,Rockwood AL,Wayne Meikle A. 차동 이온 이동성 분광법과 결합 된 LC-MS/MS 에 의한 5 개의 내인성 스테로이드의 측정에서의 성능 향상. 클린심 액타. (2015) 438:330–6. 도이:10.1016/j.cca.2014.07.036
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
25. Stoupa A,González-Briceño L,Pinto G,Samara-Boustani D,Thalassinos C,Flechtner I,et al. 비 고전적 선천성 부신 증식증에서 테트라 코삭 티드(Synacthen®)검사에 대한 부적절한 코티솔 반응:규칙의 예외? Horm Res Paediatr. (2015) 83:262–7. 도이:10.1159/000369901
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Speiser PW, Dupont J, Zhu D, Serrat J, Buegeleisen M, Tusie-Luna MT, et al. Disease expression and molecular genotype in congenital adrenal hyperplasia due to 21-hydroxylase deficiency. J Clin Invest. (1992) 90:584–95. doi: 10.1172/JCI115897
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Temeck JW,팡 SY,넬슨 C,새로운 MI. 조기 pubarche 에서 steroidogenesis 의 유전 적 결함. J Clin Endocrinol Metab. (1987) 64:609–17. doi:10.1210/jcem-64-3-609
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
28. Voutilainen R,Jääskeläinen J. 조기 adrenarche:병인학,임상 소견 및 결과. J 스테로이드 Biochem Mol Biol. (2015) 145:226–36. doi:10.1016/j.jsbmb.2014.06.004
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Oberfield SE, Sopher AB, Gerken AT. Approach to the girl with early onset of pubic hair. J Clin Endocrinol Metab. (2011) 96:1610–22. doi: 10.1210/jc.2011-0225
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Janus D, Wojcik M, Malunowicz E, Starzyk JB. 21-하이드 록시 라제 결핍으로 인한 무증상 비 고전적 선천성 부신 과형성이있는 15 개월 된 어린이의 재발 성 음순 유착의 사례. J Pediatr Endocrinol Metab. (2012) 25:1017–21. doi:10.1515/jpem-2012-0190
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
31. Gopal-Kothandapani JS,Petkar A,O’Shea E,Banerjee I. 비 고전 선천성 부신 증식의 특이한 프리젠 테이션으로서의 항문 주위 모발. BMJ 사례 담당자(2013)2013:bcr2013010123. 도이:10.1136/bcr-2013-010123
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Falhammar H, Nordenström A. Nonclassic congenital adrenal hyperplasia due to 21-hydroxylase deficiency: clinical presentation, diagnosis, treatment, and outcome. Endocrine. (2015) 50:32–50. doi: 10.1007/s12020-015-0656-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Chrousos GP, Loriaux DL, Mann DL, Cutler GB. Late-onset 21-hydroxylase deficiency mimicking idiopathic hirsutism or polycystic ovarian disease. Ann Intern Med. (1982) 96:143–8. doi: 10.7326/0003-4819-96-2-143
CrossRef Full Text | Google Scholar
34. Witchel SF. Non-classic congenital adrenal hyperplasia. Steroids. (2013) 78:747–50. doi: 10.1016/j.steroids.2013.04.010
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Carmina E, Rosato F, Jannì A, Rizzo M, Longo RA. Extensive clinical experience: relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism. J Clin Endocrinol Metab. (2006) 91:2–6. doi: 10.1210/jc.2005-1457
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Moran C,Azziz R,Weintrob N,Witchel SF,Rohmer V,Dewailly D,et al. 21-하이드 록시 라제 결핍 비 고전적 부신 과형성을 가진 여성의 생식 결과. J Clin Endocrinol Metab. (2006) 91:3451–6. 도이:10.1210/jc.2006-0062
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
37. Levin JH,Carmina E,Lobo RA. 은 부적절한 자극 호르몬 분비를 가진 환자의 다낭성 난소 증후군과 유사하는 환자의 성인-발병 선천성 부신 증식은? 페르 틸 스테 릴. (1991) 56:635–40. doi: 10.1016/S0015-0282(16)54592-0
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Carmina E, Lobo RA. Ovarian suppression reduces clinical and endocrine expression of late-onset congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Fertil Steril. (1994) 62:738–43. doi: 10.1016/S0015-0282(16)56998-2
PubMed Abstract | CrossRef Full Text | Google Scholar
39. 루드비히 E. 여성 성에서 발생하는 안드로겐 성 탈모증(일반적인 대머리)의 유형 분류. Br J Dermatol. (1977) 97:247–54. 도이:10.1111/j.1365-2133.1977.tb15179.x
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
40. Trakakis E,Papadavid E,Dalamaga M,Koumaki D,Stavrianeas N,Rigopoulos D,et al. 의 보급을 비 고전적인 선천성 부신 증식로 인하여 21-hydroxylase 결핍에서 그리스어 여성 여드름:병원-기초 단면적 연구. J Eur Acad Dermatol Venereol. (2013) 27:1448–51. 도이:10.1111/j.1468-3083.2012.04613.x
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
41. Arlt W,Willis DS,Wild SH,Krone N,Doherty EJ,Hahner S,외. 선천성 부신 과형성이있는 성인의 건강 상태:203 명의 환자를 대상으로 한 코호트 연구. J Clin Endocrinol Metab. (2010) 95:5110–21. 도이:10.1210/jc.2010-0917
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
42. Saygili F,Oge A,Yilmaz C. 시력과 신장 기능에 문제가 및 인슐린을 무감각에서 여성으로,비 고전 선천성 부신 증식로 인하여 21-hydroxylase 결핍:사이의 관계는 혈청 렙틴 레벨 및 만성들은 시력과 신장 기능에 문제가. 홈 레스.(2005)63:270-4. 도이:10.1159/000086363
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Speiser PW, Serrat J, New MI, Gertner JM. Insulin insensitivity in adrenal hyperplasia due to nonclassical steroid 21-hydroxylase deficiency. J Clin Endocrinol Metab. (1992) 75:1421–4. doi: 10.1210/jc.75.6.1421
PubMed Abstract | CrossRef Full Text | Google Scholar
44. Han TS,Stimson RH,Rees DA,Krone N,Willis DS,Conway GS,et al. 선천성 부신 과형성이있는 성인의 글루코 코르티코이드 치료 요법 및 건강 결과. 클린 내분비. (2013) 78:197–203. 도이:10.1111/cen.12045
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
45. Van Staa TP,Leufkens HG,Abenhaim L,Zhang B,Cooper C. 경구 용 코르티코 스테로이드의 사용과 골절 위험. J 뼈 광부 Res.(2000)15:993-1000. doi:10.1359/jbmr.2000.15.6.993
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Nebesio TD, Renbarger JL, Nabhan ZM, Ross SE, Slaven JE, Li L, et al. Differential effects of hydrocortisone, prednisone, and dexamethasone on hormonal and pharmacokinetic profiles: a pilot study in children with congenital adrenal hyperplasia. Int J Pediatr Endocrinol. (2016) 2016:17. doi: 10.1186/s13633-016-0035-5
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
47. Weintrob N,Dickerman Z,발터 슈뢰더 아쿠아틱 센터 E,Galatzer A,Pertzelan A. 비전 21-hydroxylase 결핍에서 유년기 어린 시절의 효과:간의 치료의 시작에 사춘기에 최종 높이입니다. Eur J 내분비. (1997) 136:188–95. doi:10.1530/eje.0.1360188
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Bonfig W, Bechtold S, Schmidt H, Knorr D, Schwarz HP. Reduced final height outcome in congenital adrenal hyperplasia under prednisone treatment: deceleration of growth velocity during puberty. J Clin Endocrinol Metab. (2007) 92:1635–9. doi: 10.1210/jc.2006-2109
PubMed Abstract | CrossRef Full Text | Google Scholar
49. Dörr HG. 21-하이드 록시 라제 결핍으로 인한 고전적인 선천성 부신 과형성 환자의 성장. Horm Res.(2007)68(Suppl5):93-9. doi:10.1159/000110587
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
50. Hoepffner W,Kaufhold A,Willgerodt 서,켈러 E. 환자는 함께 고전적인 선천성 부신 증식로 인하여 21-hydroxylase 결핍을 달성할 수 있는 그들의 대상을 높이:라이프치히 경험이다. 홈 레스.(2008)70:42-50. 도이:10.1159/000129677
PubMed Abstract | CrossRef Full Text | Google Scholar
51. van der Kaay D, van den Akker E. Ultralow-dose dexamethasone to preserve endogenous cortisol stress response in nonclassical congenital adrenal hyperplasia: a new promising treatment. Int J Endocrinol Metab. (2014) 12:e14657. doi: 10.5812/ijem.14657
CrossRef Full Text | Google Scholar
52. Lin-Su K, Vogiatzi MG, Marshall I, Harbison MD, Macapagal MC, Betensky B, et al. Treatment with growth hormone and luteinizing hormone releasing hormone analog improves final adult height in children with congenital adrenal hyperplasia. J Clin Endocrinol Metab. (2005) 90:3318–25. doi: 10.1210/jc.2004-2128
PubMed Abstract | CrossRef Full Text | Google Scholar
53. McCann-Crosby B, Chen M-J, Lyons SK, Lin Y, Axelrad M, Dietrich JE, et al. Nonclassical congenital adrenal hyperplasia: 치료 및 전환의 대상. 소아과 내분비 계 레브(2014)12:224-38.
PubMed Abstract|Google Scholar
54. Ogilvie CM,Crouch NS,Rumsby G,Creighton SM,Liao L-M,Conway GS. 성인의 선천성 부신 과형성:의학적,외과 적 및 심리적 문제에 대한 검토. 클린 내분비. (2006) 64:2–11. 도이:10.1111/j.1365-2265.2005.02410.x
PubMed Abstract | CrossRef Full Text | Google Scholar
55. Mah PM, Jenkins RC, Rostami-Hodjegan A, Newell-Price J, Doane A, Ibbotson V, et al. Weight-related dosing, timing and monitoring hydrocortisone replacement therapy in patients with adrenal insufficiency. Clin Endocrinol. (2004) 61:367–75. doi: 10.1111/j.1365-2265.2004.02106.x
PubMed Abstract | CrossRef Full Text | Google Scholar
56. 디아즈 A,A 에 PC 의 Laufer 씨 브리치 LLAA,아에 O 와 GC 의 관리 AC. 소녀 및 청소년의 월경:생리주기를 생체 신호로 사용. 소아과. (2006) 118:2245–50. 도이:10.1542/소아과.쨈챘짹쨀째쩔징 쨈챘쩔짤 쩔짭짹쨍 쩔짭짹쨍 쨈챘짹쨀째쩔징 쨈챘 쩔짭짹쨍 쨈챘짹쨀째쩔징 쨈챘 쩔짭짹쨍 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩔징 쨈챘짹쨀째쩍쨈쨈. Merke DP,Poppas DP. 선천성 부신 과형성을 가진 청소년의 관리. 란셋 당뇨병 내분비. (2013) 1:341–52. 도이:10.1016/S2213-8587(13)70138-4
PubMed Abstract | CrossRef Full Text | Google Scholar
58. Verma S, Green-Golan L, VanRyzin C, Drinkard B, Mehta SP, Weise M, et al. Adrenomedullary function in patients with nonclassic congenital adrenal hyperplasia. Horm Metab Res. (2010) 42:607–12. doi: 10.1055/s-0030-1253385
PubMed Abstract | CrossRef Full Text | Google Scholar
59. New MI. Extensive clinical experience: nonclassical 21-hydroxylase deficiency. J Clin Endocrinol Metab. (2006) 91:4205–14. doi: 10.1210/jc.2006-1645
PubMed Abstract | CrossRef Full Text | Google Scholar
60. Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. (2018) 103:4043–88. doi: 10.1210/jc.2018-01865
PubMed Abstract | CrossRef Full Text | Google Scholar
61. Kruse B, Riepe FG, Krone N, Bosinski HAG, Kloehn S, Partsch CJ, et al. Congenital adrenal hyperplasia – how to improve the transition from adolescence to adult life. Exp Clin Endocrinol Diabetes. (2004) 112:343–55. doi: 10.1055/s-2004-821013
PubMed Abstract | CrossRef Full Text | Google Scholar
62. Gastaud F,Bouvattier C,Duranteau L,Brauner R,Thibaud E,Kutten F,et al. 선천성 부신 과형성의 고전적 형태를 가진 여성의 성적 및 생식 결과 장애. J Clin Endocrinol Metab. (2007) 92:1391–6. 도이:10.1210/jc.2006-1757
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
63. Mercè Fernández-Balsells M,Muthusamy K,Smushkin G,Lampropulos JF,Elamin MB,Abu Elnour NO,et al. 태 dexamethasone 사용의 예방을 위한 남성화에서 임신을 위험에 대한 고전적인 선천성 부신 증식 때문 21-hydroxylase(CYP21A2)결핍:체계적인 리뷰 및 메타-분석한다. 클린 내분비. (2010) 73:436–44. 도이:10.1111/j.1365-2265.2010.03826.x
CrossRef 전체 텍스트|Google Scholar
64. 비데 M,Bellanné-Chantelot C,Galand-Portier MB,Golmard JL,Tardy V,Morel Y,외. Fertility in women with nonclassical congenital adrenal hyperplasia due to 21-hydroxylase deficiency. J Clin Endocrinol Metab. (2010) 95:1182–90. doi: 10.1210/jc.2009-1383
PubMed Abstract | CrossRef Full Text | Google Scholar
65. Birnbaum MD, Rose LI. Late onset adrenocortical hydroxylase deficiencies associated with menstrual dysfunction. Obstet Gynecol. (1984) 63:445–51.
PubMed Abstract | Google Scholar
66. Cuhaci N, Aydin C, Yesilyurt A, Pinarli FA, Ersoy R, Cakir B. Nonclassical congenital adrenal hyperplasia and pregnancy. Case Rep Endocrinol. (2015) 2015:296924. doi: 10.1155/2015/296924
PubMed Abstract | CrossRef Full Text | Google Scholar
67. Deneux C, Tardy V, Anne D, Mornet E, Billaud L, Charron D, et al. 21-하이드 록 실라 제 결핍으로 인한 비 고전적 선천성 부신 과형성이있는 56 명의 여성에서 표현형-유전자형 상관 관계. J Clin Endocrinol Metab. (2001) 86:207–13. doi:10.1210/jcem.86.1.7131
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
68. Simonetti L,Bruque CD,Fernández CS,Benavides-Mori B,Delea M,Kolomenski JE,et al. CYP21A2 돌연변이 업데이트:데이터베이스 및 게시 된 유전자 변이체에 대한 포괄적 인 분석. 험 무타트. (2018) 39:5–22. 도이:10.1002/휴무.23351
PubMed Abstract | CrossRef Full Text | Google Scholar
69. OMIM Entry – * 613815 – CYTOCHROME P450 FAMILY 21 SUBFAMILY A POLYPEPTIDE 2; CYP21A2.
Google Scholar
70. Miller WL, Witchel SF. Prenatal treatment of congenital adrenal hyperplasia: risks outweigh benefits. Am J Obstet Gynecol. (2013) 208:354–9. doi: 10.1016/j.ajog.2012.10.885
PubMed Abstract | CrossRef Full Text | Google Scholar
71. Lekarev O, New MI. Adrenal disease in pregnancy. Best Pract Res Clin Endocrinol Metab. (2011) 25:959–73. doi: 10.1016/j.beem.2011.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
72. New MI, Abraham M, Yuen T, Lekarev O. An update on prenatal diagnosis and treatment of congenital adrenal hyperplasia. Semin Reprod Med. (2012) 30:396–9. doi: 10.1055/s-0032-1324723
PubMed Abstract | CrossRef Full Text | Google Scholar
73. Kazmi D, Bailey J, Yau M, Abu-Amer W, Kumar A, Low M, et al. New developments in prenatal diagnosis of congenital adrenal hyperplasia. J Steroid Biochem Mol Biol. (2017) 165:121–3. doi: 10.1016/j.jsbmb.2016.06.016
PubMed Abstract | CrossRef Full Text | Google Scholar
74. Clayton PE,Miller WL,Oberfield SE,Ritzén EM,Sippell WG,Speiser PW,et al. 합의 문서 21-hydroxylase 결핍에서 유럽의 사회에 대한 소아 내분비학와 로손 wilkins 소아 내분비 society. 홈 레스.(2002)58:188-95. doi:10.1159/000065490
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
75. Nandagopal R,Sinaii N,Avila NA,Van Ryzin C,Chen W,Finkielstain GP,et al. 비밀스러운 비 고전적 선천성 부신 과형성을 가진 부모의 표현형 프로파일 링:145 명의 관련없는 가족에서 발견. Eur J 내분비. (2011) 164:977–84. doi:10.1530/EJE-11-0019
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
76. 과 직결된 편리한 입 N,Nakachi K,히가 H. 개발의 무덤’갑상선기능항진증해 발생하는 부신에서 위기와 환자가 이전에 알 수 없는 비전 21-hydroxylase 분이 포함되어 있습니다. 인턴 의대. (2010) 49:1395–400. doi:10.2169/내부 의학.49.3573
PubMed Abstract | CrossRef Full Text | Google Scholar
77. Meyer-Bahlburg HFL, Dolezal C, Baker SW, Carlson AD, Obeid JS, New MI. Prenatal androgenization affects gender-related behavior but not gender identity in 5-12-year-old girls with congenital adrenal hyperplasia. Arch Sex Behav. (2004) 33:97–104. doi: 10.1023/B:ASEB.0000014324.25718.51
CrossRef Full Text | Google Scholar
78. Meyer-Bahlburg HFL,Dolezal C,Baker SW,New MI. 태아 안드로겐 과잉 정도의 함수로서 고전적 또는 비 고전적 선천성 부신 과형성이있는 여성의 성적 취향. 아치는 섹스는 행동. (2008) 37:85–99. doi:10.1007/s10508-007-9265-1 나는 이것이 내가 할 수있는 유일한 방법이라고 생각한다.