hur mycket energi frigörs vid ATP-hydrolys?
läsarläge
ATP kallas ofta cellens energivaluta. Hundratals reaktioner i cellen från metaboliska transformationer till signalhändelser kopplas till hydrolysen (bokstavligen betyder ”vattenlösning”) av ATP med vatten . Reaktionen ATP + H2O <> ADP + Pi omvandlar adenosintrifosfat (ATP) till adenosindifosfat (ADP) och oorganiskt fosfat (Pi). Den fria energiförändringen i samband med denna reaktion driver en stor del av cellulära reaktioner med membranpotentialen och reducerande kraft är de andra två dominerande energikällorna. Men exakt hur mycket är denna energivaluta värd och vad avslöjar den om de kemiska transaktioner som kan köpas? Naturligtvis finns det inget svar på denna fråga eftersom mängden energi som frigörs av denna hydrolysreaktion beror på de intracellulära förhållandena, men det är möjligt att få en känsla för det ungefärliga ”värdet” av denna valuta genom att tillgripa några enkla uppskattningar.

Figur 1: förhållandet mellan Gibbs fria energi av ATP-hydrolys under standardbetingelser till jämviktskonstanten och förhållandet mellan den fria energin av hydrolys under fysiologiska förhållanden till de fysiologiska reaktantkoncentrationerna.
Gibbs fria energiförändring (CYRG) på grund av ATP-hydrolys beror på koncentrationerna av de olika deltagarna i reaktionen som avbildas i Figur 1. När koncentrationerna är längre från deras jämviktsvärden är det absoluta värdet av KUBG större. Under” standard ” förhållanden (dvs. koncentrationer av 1M för alla reaktanter utom vatten som tas vid dess karakteristiska koncentration av 55M) Gibbs fria energi av ATP-hydrolys varierar från -28 till -34 kJ/mol (dvs. 12 KBT, bnid 101989) beroende på koncentrationen av katjonen Mg2+. Beroendet av Mg-joner uppstår eftersom de positivt laddade magnesiumjonerna hjälper till att stabilisera ATP-molekylen. Men i cellen är förhållandena aldrig ens nära standardstatsvärdena. Till exempel skulle en koncentration av 1M ATP innebära att massan av löst ämne skulle likna den hos själva vattenlösningsmedlet. I Figur 1 visar vi den ofta förvirrande derivationen av den fysiologiska fria energin (UKG) med tanke på förhållandet mellan koncentrationer från standardvärdet (Ukgo). Uppdelningen med termer som krävs för att ta hand om enheter som en logaritm bör alltid innehålla en enhetslös term. Det är ibland förvånande att tro att om cellen var i jämvikt, skulle värdet av KUBG ha varit noll, och det skulle inte finnas någon energi att vinna genom ATP-hydrolys. Lyckligtvis är detta aldrig fallet i levande organismer. .
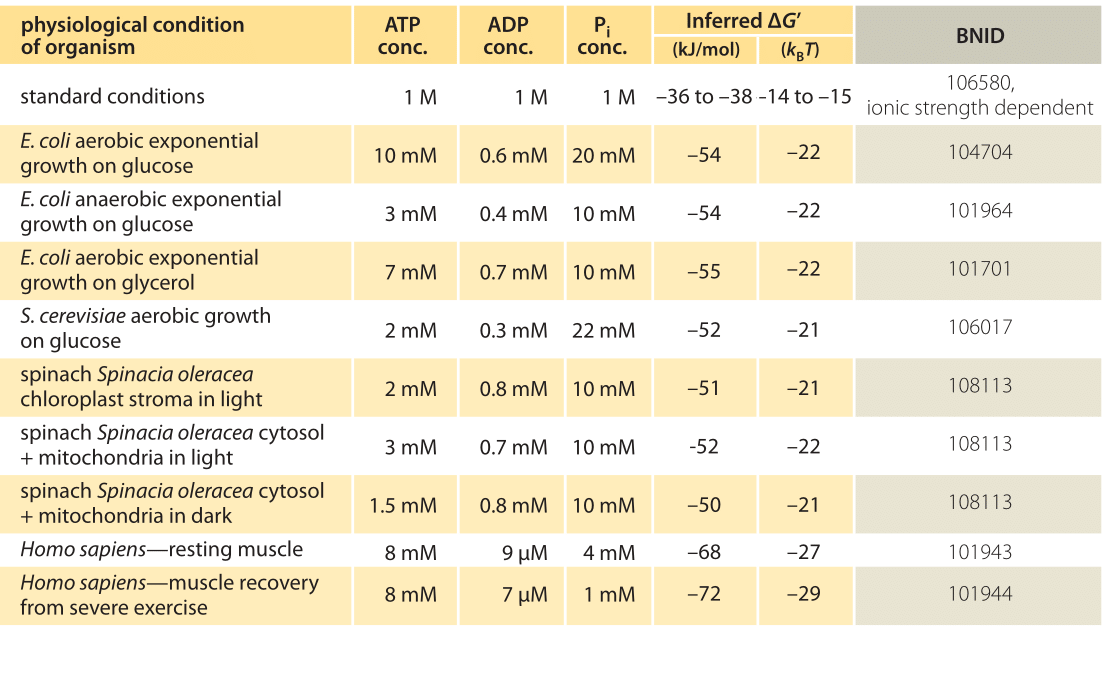
tabell 1: fri energi för ATP-hydrolys i olika organismer och under olika fysiologiska förhållanden. Härledda beräkningar baserade på ett värde av 0 på -37,6 kJ/mol. Detta gör tabellvärdena konsekventa mellan sig men skapar små avvikelser från de värden som anges i de primära källorna. Sådana avvikelser kan bero på variationer i jonstyrka, pH och mätmetoder fördomar. Värdena avrundas till en eller två signifikanta siffror. I spenat, där Pi-koncentration inte rapporterades, användes ett karakteristiskt värde på 10 mM (BNID 103984, 103983, 111358, 105540).
i praktiken beror de fysiologiska förhållandena på organismen som studeras, vävnaden eller facket i den aktuella cellen och på de aktuella energibehoven för metaboliska och andra reaktioner. Till exempel i perfuserad råttlever befanns ATP-ADP-förhållandet vara cirka 10:1 i cytosolen men 1:10 i mitokondrierna under höga glykolyshastigheter och under låga glykolyshastigheter var båda förhållandena mycket nära 1 (BNID 111357). Därför förväntas ett intervall av värden för KUBG. Nyckeln till att förstå detta intervall är att få en känsla av hur mycket Q skiljer sig från K, dvs hur koncentrationerna skiljer sig från standardvillkor. De typiska intracellulära koncentrationerna av alla relevanta komponenter (ATP, ADP och Pi) ligger inom mM-området, mycket lägre än standardbetingelser. Förhållandet / med koncentrationer i mM-intervallet är mycket lägre än ett, och reaktionen kommer att vara energiskt mer gynnsam än vid standardförhållanden som visas i Tabell 1. Det högsta värdet av 70 kJ/mol (30 KBT) beräknades från värden i den mänskliga muskeln hos idrottare som återhämtade sig efter ansträngning (BNID 101944). I E. coli-celler som växte på glukos rapporterades ett värde på -47 kJ/mol (20kbt, BNID 101964). För att sätta dessa siffror i perspektiv fungerar en molekylmotor som utövar en kraft på ungefär 5 pN (BNID 101832) över en 10 nm (BNID 101857) stegstorlek 50 PN nm, vilket kräver något mer än 10 kBT energi, väl inom intervallet för vad en enda ATP kan leverera.
beräkningarna av KUBG kräver en noggrann mätning av relevanta intracellulära koncentrationer. Sådana koncentrationer mäts in vivo hos människor genom användning av kärnmagnetisk resonans. Den naturliga formen av fosfor (31P) har magnetiska egenskaper, så det finns inget behov av att lägga till någon extern substans. Vävnaden av intresse som muskel placeras i ett starkt magnetfält och skift i frekvensen av radiopulser används för att härleda koncentrationen av ATP och Pi direkt från topparna i NMR-spektra. I E. coli, koncentrationerna av ATP kan mätas mer direkt med en ATP bioluminescensanalys. Ett urval av växande bakterier som tagits bort från kulturen kan analyseras med luciferas, ett protein från bakterier som lever i symbios med bläckfiskar men som nu har gått med i verktygslådan för biologer som molekylär reporter. Luciferasenzymet använder ATP i en reaktion som producerar ljus som kan mätas med hjälp av en luminometer, och ATP-koncentrationen kan härledas från signalstyrkan. Så vi har cellinnehåll som en ingång, luciferas som en ”enhet” som omvandlar mängden ATP till ljusutsläpp som fungerar som den uppmätta utgången. Med hjälp av verktyg som dessa finner man att ATP i ”verkliga livet” är värt ungefär dubbelt så mycket som under ”vanliga” förhållanden på grund av att koncentrationerna är mer gynnsamma för den framåtriktade reaktionen.
Vi avslutar med att notera att det är en stående fråga om varför adeninnukleotiden utpekades för att fungera som den viktigaste energivalutan med GTP och de andra nukleotiderna som tjänar mycket mer mindre roller. Är det ett fall av slumpmässigt val som senare blev ”frusen olycka” eller var det en selektiv fördel för ATP över GTP, CTP, UTP och TTP?




