mivel az új hidroxidionok nagy részét eltávolítják, a pH nem növekszik nagyon.
a hidroxidionok eltávolítása hidrogénionokkal reagálva
ne feledje, hogy vannak hidrogénionok az etánsav ionizációjából.
![]()
![]()
Amint ez megtörténik, Az egyensúlyi tippek helyettesítik őket. Ez addig tart, amíg a hidroxidionok nagy részét el nem távolítják.
![]()
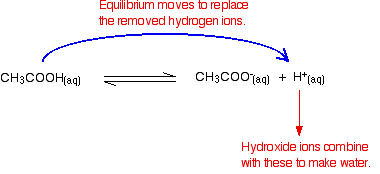
ismét, mert equilibria van benne, nem minden hidroxidion eltávolításra kerül – csak a legtöbbjük. A képződött víz nagyon kis mértékben újra ionizálódik, így néhány hidrogénion és hidroxid Ion keletkezik.
Alkáli pufferoldatok
jellemző az ammónia és ammónium-klorid oldatok keveréke.
az ammónia gyenge bázis, ennek az egyensúlynak a helyzete jól balra lesz:
![]()
![]()
ammónium-klorid hozzáadása ehhez sok extra ammónium-iont ad hozzá. A Le Chatelier-elv szerint ez az egyensúly helyzetét még tovább fogja billenteni balra.
A megoldás tehát tartalmazza ezeket a fontos dolgokat:
-
sok reaktív ammónia;
-
sok ammónium-ionok a ammónium-klorid;
-
elég-hidroxid-ionok, hogy az oldat lúgos.
egyéb dolgok (például víz-és kloridionok), amelyek jelen vannak, nem fontosak az érveléshez.
sav hozzáadása ehhez a pufferoldathoz
két folyamat van, amelyek eltávolíthatják a hozzáadott hidrogénionokat.
Eltávolítás ammóniával reagálva
a legvalószínűbb alapanyag, amellyel egy hidrogénion ütközik, ammónia molekula. Reagálnak ammóniumionok képződésére.
![]()
![]()
a legtöbb, de nem az összes hidrogénion eltávolításra kerül. Az ammónium-ion gyengén savas, így a hidrogénionok egy része újra felszabadul.
a hidrogénionok eltávolítása hidroxidionokkal reagálva
ne feledje, hogy az ammónia és a víz közötti reakcióban vannak hidroxidionok.
![]()
![]()
a hidrogénionok kombinálhatók ezekkel a hidroxidionokkal a víz előállításához. Amint ez megtörténik, Az egyensúlyi tippek a hidroxidionok cseréjéhez. Ez addig tart, amíg a hidrogénionok nagy részét eltávolítják.
![]()
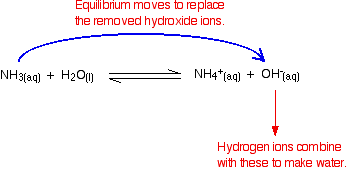
ismét, mert equilibria érintett, nem minden a hidrogénion eltávolítjuk – csak a legtöbbjük.
alkáli hozzáadása ehhez a pufferoldathoz
az alkáli hidroxidionokat egyszerű ammóniumionokkal történő reakcióval távolítják el.
![]()
![]()
mivel a képződött ammónia gyenge bázis, a vízzel reagálhat – így a reakció enyhén reverzibilis. Ez azt jelenti, hogy ismét a hidroxidionok nagy részét (de nem mindegyikét) eltávolítják az oldatból.
pufferoldatokat érintő számítások
Ez csak egy rövid bevezetés. Több példa van, beleértve több variációt is, felett 10 oldalak a kémiai számítások könyvében.
savas pufferoldatok
Ez egy adott példával könnyebben látható. Ne feledje, hogy a sav puffer lehet egy gyenge sav és annak egyik sója.
tegyük fel, hogy volt egy pufferoldat, amely 0,10 mol dm-3 etánsavat és 0-at tartalmazott.20 mol dm-3 nátrium-etanoát. Hogyan lehet kiszámítani a pH-értékét?
bármely gyenge savat tartalmazó oldatban egyensúly van a nem ionizált sav és ionjai között. Tehát az etánsav esetében az egyensúly:
![]()
![]()
az etanoátionok jelenléte a nátrium-etanoátból balra mozgatja az egyensúlyt, de az egyensúly továbbra is fennáll.
Ez azt jelenti, hogy meg lehet írni az egyensúlyi állandót, Ka, érte:
![]()
![]()
ahol korábban gyenge savval végzett számításokat, akkor feltételezhető, hogy a hidrogénionok és az etanoát ionok koncentrációja azonos volt. Az etánsav minden molekulája, amely feloszlik, mindegyik fajta iont ad.
Ez már nem igaz egy pufferoldatra:
![]()
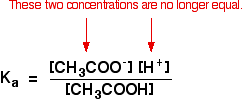
Ha az egyensúlyt még tovább tolták balra, az etánsavból származó etanoátionok száma teljesen elhanyagolható lesz a nátrium-etanoáthoz képest.
ezért feltételezzük, hogy az etanoát ion koncentrációja megegyezik a nátrium – etanoát koncentrációjával-ebben az esetben 0, 20 mol dm-3.
gyenge savszámításnál általában azt feltételezzük, hogy a sav olyan kevés ionizált, hogy a sav koncentrációja egyensúlyban megegyezik az általunk használt sav koncentrációjával. Ez még inkább igaz most, hogy az egyensúlyt még tovább mozgatták balra.
tehát a pufferoldatra vonatkozó feltevések a következők:
![]()
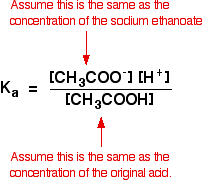
most, ha tudjuk a Ka értékét, kiszámolhatjuk a hidrogénion koncentrációját, ezért a ph.
Ka az etánsav esetében 1,74 x 10-5 mol dm-3.
ne feledje, hogy 0,10 mol dm-3 etánsavat és 0,20 mol dm-3 nátrium-etanoátot tartalmazó pufferoldat pH-ját akarjuk kiszámítani. ![]()
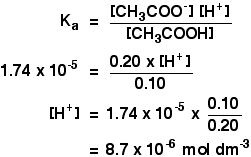
Akkor csak annyit kell tennie, hogy megtalálja a pH-t használja a kifejezést,
pH = -log10
továbbra is az érték a hidrogén-ion koncentráció a számológép, szóval nyomja meg a bejelentkezés gombot, majd figyelmen kívül hagyni a negatív előjel (ahhoz, hogy a mínusz jel a pH kifejezés).
5, 1-2 jelentős számot kell kapnia. Ennél azért nem lehet pontosabb, mert a koncentrációjukat csak két számjegyű összegben adták meg.