Ha valaha is tanulmányozta az elemek periódusos táblázatát (lásd alább), valószínűleg már tudatában van annak, hogy ez a táblázat sokat tár fel a világunkat alkotó atomok kémiai tulajdonságairól.
de lehet, hogy nem veszi észre, hogy a periódusos rendszer minden négyzete valójában egy izotópcsaládot képvisel-atomokat, amelyek azonos névvel és kémiai tulajdonságokkal rendelkeznek, de különböző tömegekkel rendelkeznek.
ahhoz, hogy megértsük, mik az izotópok és hogyan tudjuk használni őket, közelebbről meg kell vizsgálnunk egy atom belsejét.

az anyag építőkövei
egy atom protonok és neutronok hihetetlenül sűrű magjából (úgynevezett magjából) áll, melyet diffúz elektronfelhő vesz körül.
Azt hiszem, protonok, illetve neutronok, mint az azonos típusú részecskék egyik legfontosabb különbség: a protonok pozitív töltésű, míg a neutronok nem hordoznak felelős. Ez azt jelenti, hogy a protonok” érzik ” az elektromos vagy mágneses mezőket, míg a neutronok nem.
azok az elektronok, amelyek sokkal könnyebbek a protonoknál vagy neutronoknál, ugyanolyan nagyságú töltést hordoznak, mint egy proton, de ellentétes jellel, ami azt jelenti, hogy minden olyan atom, amelynek azonos számú protonja és elektronja van, elektromosan semleges.
az elektronok határozzák meg egy adott elem kémiai viselkedését.

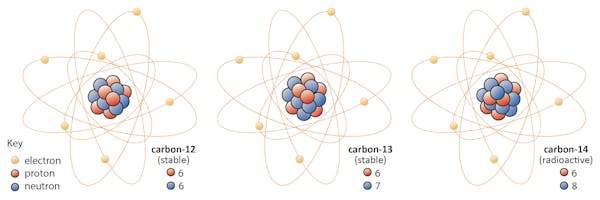
egy elem izotópjai ugyanannyi protonnal rendelkeznek, de különböző számú neutronnal rendelkeznek. Példaként használjuk a szenet.
a természetben három szénizotóp található: a szén – 12, a szén-13 és a szén-14. Mindhárom hat protonnal rendelkezik, de neutronszámuk – 6, 7, illetve 8 – különbözik egymástól. Ez azt jelenti, hogy mindhárom izotóp különböző atomtömegekkel rendelkezik (a szén-14 a legnehezebb), de azonos atomszámmal rendelkezik (Z=6).
kémiailag mindhárom megkülönböztethetetlen, mivel az elektronok száma mindhárom izotópban azonos.
tehát ugyanazon elem különböző izotópjai azonosak, kémiailag. De egyes izotópok képesek megkerülni ezt a szabályt egy másik elemré való átalakítással.
menetel a stabilitás felé
Ez a transzformatív képesség egyes izotópoknak köze van ahhoz, hogy nem minden izotóp stabil, és ez vezette Frederick Soddyt az izotópok Nobel-díjas felfedezéséhez 1913-ban.
egyes izotópok-például a szén – 12-boldogan továbbra is szénként léteznek, kivéve, ha valami rendkívüli történik. Mások-szén-14, mond – egy bizonyos ponton egy stabil izotópba bomlanak a közelben.
ebben az esetben a szén-14 egyik neutronja protonná változik, nitrogént képezve-14. Ez alatt a folyamat alatt, amelyet béta-bomlásnak neveznek, a mag sugárzást bocsát ki elektron és antineutrino formájában.
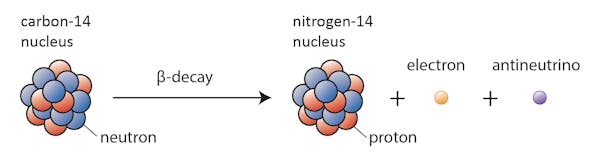
számos tényező okozhatja a mag bomlását. Az egyik legfontosabb a protonok aránya az adott mag neutronjaihoz. Ha egy magnak túl sok neutronja van (a “túl sok” meghatározása attól függ, hogy milyen nehéz a mag), akkor valószínű, hogy a stabilitás felé bomlik.
ugyanez igaz, ha egy magnak túl sok protonja van. Ez az egyik oka annak, hogy egy adott elem egyes izotópjai radioaktívak, míg mások nem.
A csillagok hasából
mostanra kíváncsi lehet, hogy ezek az izotópok elsősorban hogyan jöttek létre. Mint kiderül, ez a kérdés összetett, de némi igazságot kölcsönöz annak a mondásnak, hogy mindannyian csillagporból készülünk.
néhány könnyebb izotóp nagyon korán alakult ki az univerzum történetében, az Ősrobbanás alatt. Mások olyan folyamatokból származnak, amelyek a csillagokon belül vagy a légkörünkben a rendkívül energikus magok – kozmikus sugarak – közötti véletlen ütközések eredményeként következnek be.
a természetben létező izotópok többsége a nukleáris reakciók és bomlások hosszú sorozatából eredő végső (stabil vagy hosszú élettartamú) termék.
a legtöbb ilyen esetben, könnyű atommagok kellett törni együtt elég energia, hogy lehetővé tegye az erős erő – egy ragasztó -, mint a kötelék, ami akkor alakul ki, ha a protonok, illetve neutronok elég közel, hogy a touch – leküzdeni az elektromágneses erő – ami tolja protonok egymástól. Ha az erős erő nyer, az ütköző magok összekapcsolódnak, vagy összeolvadnak, hogy nehezebb magot képezzenek.
a napunk jó példa erre. Egyik fő energiaforrása a fúziós reakciók és a béta-bomlási folyamatok sorozata,amelyek a hidrogént héliummá alakítják.

A tudás szerszámokká való átalakítása
az 1900-as évek eleje óta, amikor az izotópok létezése először megvalósult, a nukleáris fizikusok és kémikusok keresik a módját annak tanulmányozására, hogyan alakulhatnak ki az izotópok, hogyan bomlanak le, és hogyan használhatjuk őket.
mint kiderült, az izotópok természete-kémiai egységességük – nukleáris megkülönböztető képességük-olyan sokféle felhasználási területen teszi őket hasznossá, mint az orvostudomány, a régészet, a mezőgazdaság, az energiatermelés és a bányászat.
Ha valaha is volt PET-vizsgálat, akkor bizonyos izotópok (gyakran orvosi izotópoknak nevezett) radioaktív bomlásának mellékterméke volt. Ezeket az orvosi izotópokat a nukleáris reakciók folytatásának ismeretével állítjuk elő atomreaktorok vagy gyorsítók, úgynevezett ciklotronok segítségével.
de megtaláltuk a természetben előforduló radioaktív izotópok használatának módját is. Szén társkereső, például, kihasználja a hosszú élettartamú izotóp szén-14 annak meghatározására, hogy hány éves tárgyak.
normál körülmények között a szén – 14-et légkörünkben nitrogén-14-es kozmikus sugárreakciókkal állítjuk elő. Felezési ideje nagyjából 5700 év, ami azt jelenti, hogy a szén-14 mennyiségének fele el fog pusztulni ebben az időszakban.

míg egy biológiai szervezet él, körülbelül egy szén-14 izotópot vesz fel minden billió stabil szén-12 izotóphoz, a szén-12-szén-14 arány pedig körülbelül azonos marad, amíg a szervezet él. Amint meghal, az új szénbevitel leáll.
Ez azt jelenti, hogy a szén-14 és a szén-12 aránya idővel megváltozik a szervezet maradványaiban.
ha kémiai módszerekkel kivonjuk a szenet egy mintából, akkor alkalmazhatunk egy gyorsító tömegspektrometriának (AMS) nevezett módszert az egyes szénizotópok tömeg szerinti elválasztására.
az AMS kihasználja azt a tényt, hogy az azonos töltésű, de különböző tömegű gyorsított részecskék külön utakat követnek a mágneses mezőkön keresztül. Ezeknek a különálló utaknak a felhasználásával hihetetlen pontossággal meghatározhatjuk az izotóp arányokat.
amint az ezekből a példákból látható, az izotópokkal kapcsolatos ismereteinket számos módon alkalmazzuk. Gyártunk nekik, észlelni őket, kivonat őket, tanulni őket a kettős célja annak megértése, hogy miért az atommag úgy viselkedik, mint, hogyan hasznosítjuk a hatalom a haszon.