9.5 az Octet szabály megsértése
tanulási cél
- felismeri az octet szabály három fő megsértését.
olyan fontos és hasznos, mint az oktettszabály a kémiai kötésben, vannak jól ismert jogsértések. Ez nem jelenti azt, hogy az oktett szabály haszontalan—éppen ellenkezőleg. Mint sok szabály esetében, vannak kivételek vagy jogsértések.
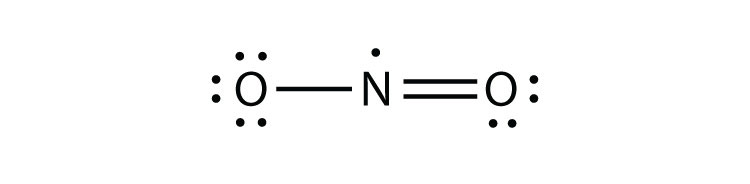
az octet szabálynak három megsértése van. Páratlan elektron molekulákegy olyan molekula, amelynek páratlan számú elektronja van egy atom valenciahéjában. képviselje az octet szabály első megsértését. Bár kevés, néhány stabil vegyületnek páratlan számú elektronja van a valenciahéjukban. Páratlan számú elektron esetén a molekulában legalább egy atomnak meg kell sértenie az oktettszabályt. Példák a stabil páratlan elektronmolekulákra: NO, NO2 és ClO2. A Lewis electron Dot diagram NO a következő:
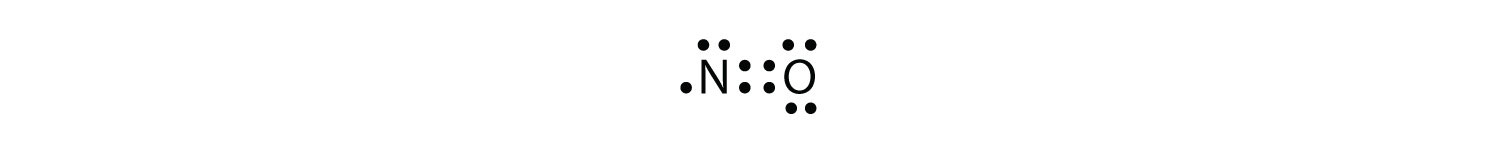
bár az O atom oktett elektronok, az n atom csak hét elektronok annak valenciahéj. Bár nem egy stabil vegyület, nagyon kémiailag reaktív, mint a legtöbb más páratlan elektron vegyületek.
elektronhiányos molekulákegy olyan molekula, amelynek kevesebb mint nyolc elektronja van egy atom valenciahéjában. képviselje az octet szabály második megsértését. Ezeknek a stabil vegyületeknek kevesebb, mint nyolc elektronja van egy atom körül a molekulában. A leggyakoribb példák a berillium és a bór kovalens vegyületei. Például a berillium két kovalens kötést képezhet, ami csak négy elektront eredményez a valenciahéjában:
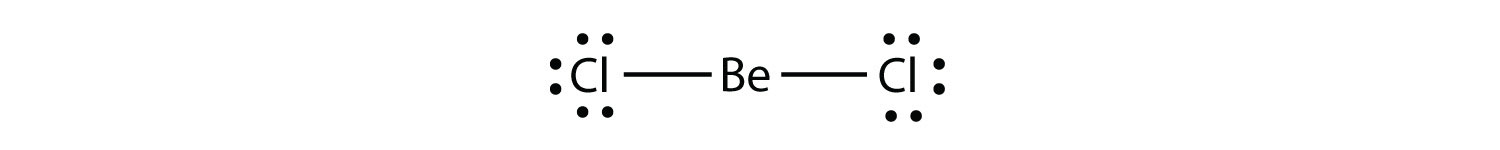
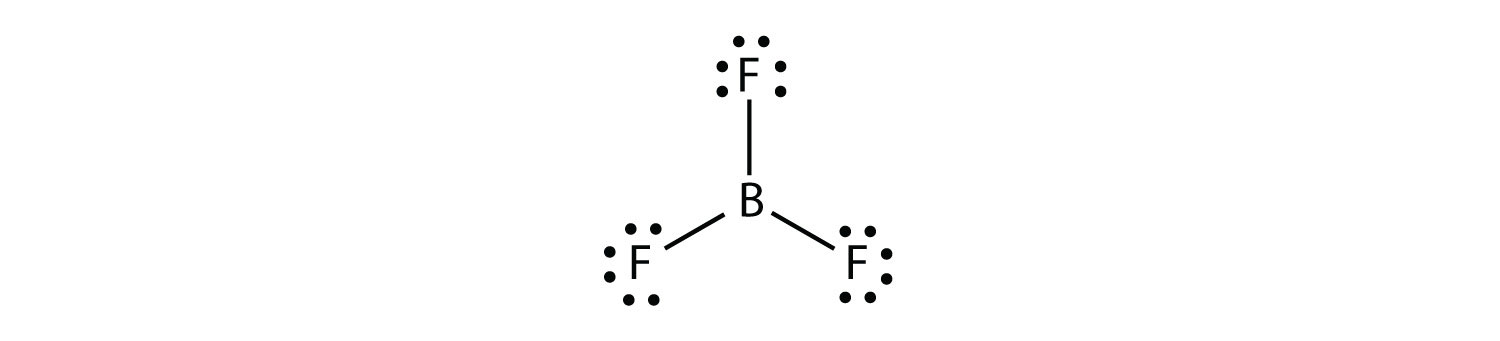
a bór általában csak három kovalens kötést hoz létre, ami csak hat valence elektront eredményez a B atom körül. Egy jól ismert példa a BF3:
A harmadik sérti az oktett szabály megtalálható azok a vegyületek, több mint nyolc elektronok rendelni a valence shell. Ezeket kiterjesztett valence héj molekuláknak nevezikegy olyan molekula, amelynek több mint nyolc elektronja van az atom valenciahéjában.. Az ilyen vegyületeket csak a periódusos rendszer harmadik sorában lévő központi atomok képezik, vagy azon túl, amelyeknek üres d pályái vannak a valenciahéjukban, amelyek részt vehetnek a kovalens kötésben. Az egyik ilyen vegyület a PF5. Az egyetlen ésszerű Lewis elektron pont diagram ez a vegyület az O atom, hogy öt kovalens kötés:
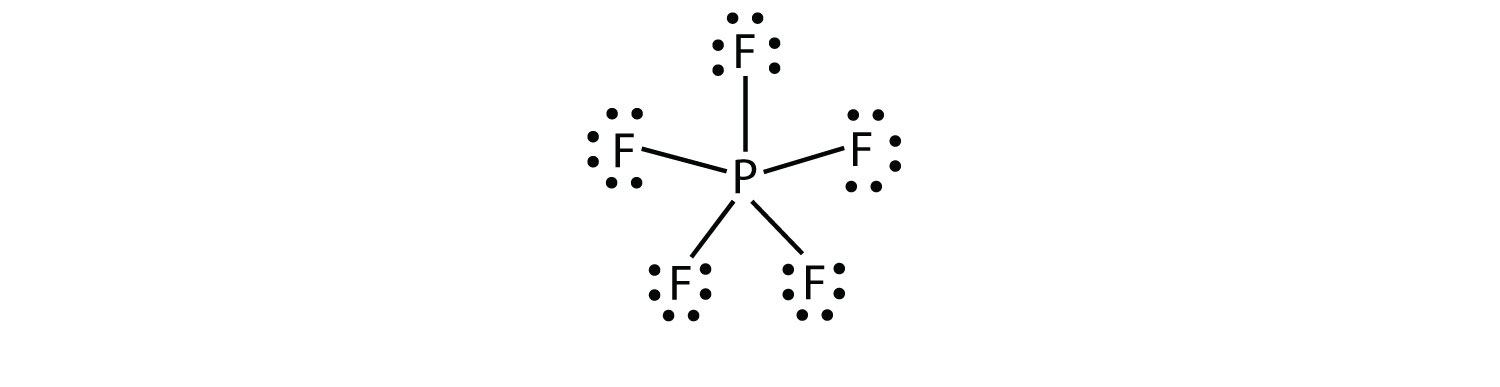
Hivatalosan, az O atom 10 elektronok a valence shell.
9. példa
azonosítsa az oktet-szabály minden megsértését Lewis electron dot diagram rajzolásával.
- ClO
- SF6
megoldás
-
egy Cl atom és egy O atom esetén ez a molekula 6 + 7 = 13 valence elektronokkal rendelkezik, tehát páratlan elektronmolekula. Egy Lewis elektron pont diagram ez a molekula a következőképpen:

-
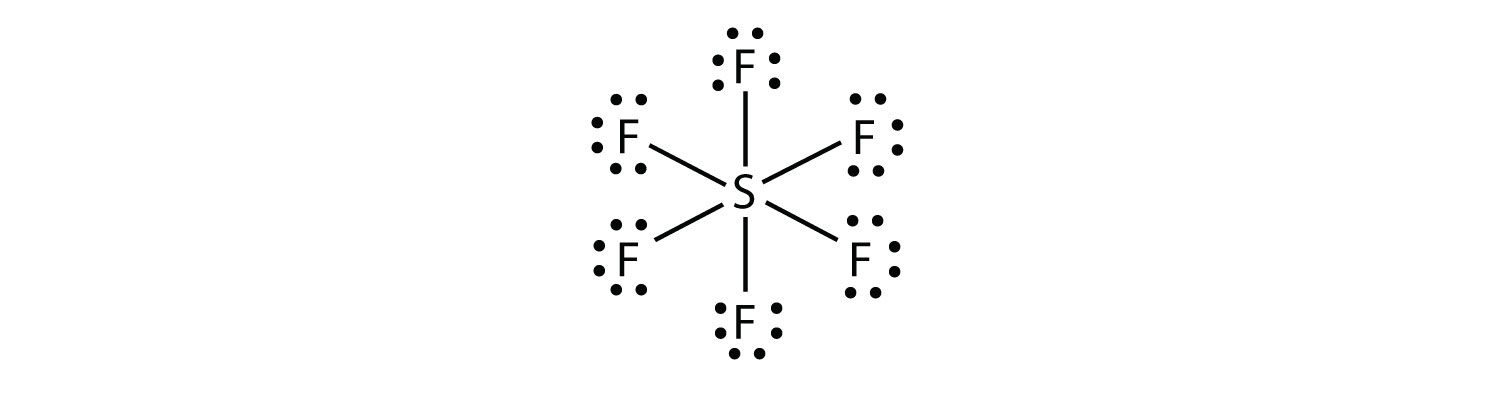
Az SF6, a központi S atom hatodik kovalens kötés, hogy a hat környező F atomok, így kiterjesztett valence shell molekula. A Lewis electron dot diagram a következő:
tesztelje magát
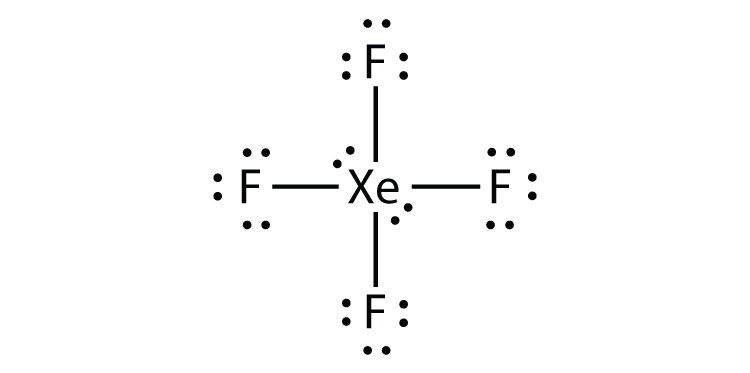
azonosítsa az octet szabály megsértését XeF2-ben egy Lewis electron dot diagram rajzával.
válasz
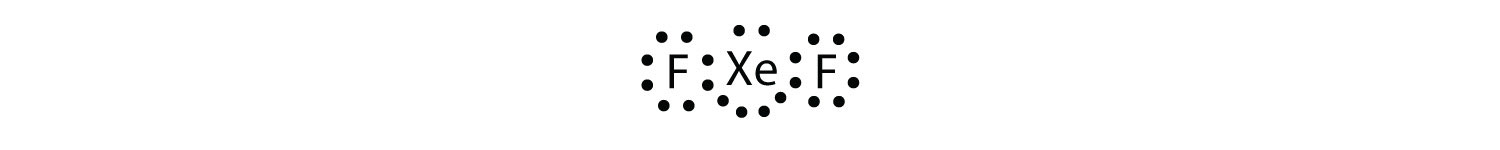
az Xe atom kiterjesztett valence héjjal rendelkezik, több mint nyolc elektronnal körülötte.
Key Takeaway
- az oktet-szabálynak három megsértése van: páratlan elektronmolekulák, elektronhiányos molekulák és expandált valenciahéjmolekulák.
-
miért nem képes egy páratlan elektronmolekula kielégíteni az oktet szabályt?
-
miért nem képezhet a periódusos rendszer második sorában lévő atom kiterjesztett valenciahéj molekulákat?
-
rajzoljon elfogadható Lewis elektron Dot diagramot ezekre a molekulákra, amelyek megsértik az oktet szabályt.
- NO2
- XeF4
-
rajzoljon elfogadható Lewis elektronpont diagramot ezekre a molekulákra, amelyek megsértik az oktet szabályt.
- bcl3
- ClO2
rajzoljon elfogadható Lewis elektronpont diagramot ezekre a molekulákra, amelyek megsértik az oktett szabályt.
- POF3
- ClF3
rajzoljon elfogadható Lewis elektronpont diagramot ezekre a molekulákra, amelyek megsértik az oktet szabályt.
- SF4
- BeH2
válaszok
-
nincs mód arra, hogy minden elektron párosítható legyen, ha páratlan szám van.
-
-
-
-