- introduktion
- material och metoder
- stammar
- DNA-extraktion
- STX1 och stx2 PCR-Amplifieringar
- DNA-sekvensering
- microplate Vero Cells Preparations
- cellfria bakteriepreparat
- cytotoxisk analys och LD50-bestämning
- blockad-och Toxinneutraliseringsanalys
- Omvs-upphandling och DNA-extraktion från Omvs
- resultat
- STX1-och stx2-Gen PCR-Amplifieringar
- DNA-sekvensering
- cytotoxisk analys och LD50-bestämning
- Toxinneutralisering
- STX1-Gen PCR-Amplifieringar från omv
- diskussion
- Författarbidrag
- Finansieringen
- intressekonflikt uttalande
- erkännanden
- förkortningar
introduktion
under flera år, betydelsen av Aeromonas spp., som ett humant diarre-orsakande medel var kontroversiellt; flera studier visade att den patogena mekanismen för Aeromonas är multifaktoriell eftersom många virulensfaktorer är involverade, inklusive produktion av cytotoxiner (Castro-Escarpulli et al., 2002, 2003). Dessa toxiner kan orsaka diarre eller hemorragisk kolit och kan spela en viktig roll i det hemolytiska uremiska syndromet (HUS) och TTP-utveckling (Bogdanovi Xiai et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
de cytotoxiner som är inblandade i dessa sjukdomar inkluderar Shiga-toxin och den närbesläktade Stx. STX-varianter uttrycks i Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter och Hamiltonella bakteriearter (Mauro och Koudelka, 2011). Alperi och Figueras (2010) beskrev närvaron av Stx1 och Stx2 i kliniska isolat av Aeromonas spp., associerad med gastroenterit, hemorragisk kolit och HUS. Gener som kodar för dessa toxiner finns i olika lambdoid bakteriofager som lysogeniserar denna stam. Dessutom har släktet Aeromonas ett nollsekretionssystem som heter omvs. Omv kan vara ett sätt genom vilket vissa proteiner, RNA, periplasmiska rymdkomponenter och andra komponenter associerade med virulens kan överföras horisontellt till andra släkten; därför antas det att omv spelar en viktig roll i patogenicitet (Guerrero-Mandujano et al., 2015a, b).av denna anledning var syftet med denna studie att utvärdera skadorna orsakade av produktionen av Stx av stammar isolerade från Mexico City-barn i Vero-cellkulturer.
material och metoder
stammar
denna studie inkluderade 66 kliniska isolat från INP, 54 erhållna från tarm och 12 från extra-tarminfektioner. Stammar isolerades från prover som erhölls för rutintestning på det nämnda sjukhuset; därför krävdes inget informerat samtycke från föräldrar eller vårdnadshavare till barn. Alla stammar identifierades genetiskt av 16S rDNA-RFLP (Hern Acigndez-Cortez et al., 2011). Den typade stammen för Escherichia coli O157: H7 CECT 4076 användes som den positiva kontrollen och E. coli K12-stammen (5512 ENCB) från samlingen av Medical Bacteriology Laboratory (Escuela Nacional de Ciencias Biologicas, IPN) användes som den negativa kontrollen för toxinproduktion. Stammarna bibehölls under korta perioder vid rumstemperatur på blodagarbaserade snedställningar; för längre lagring frystes de antingen vid -70 C-C i 20% (w/V) glycerol-Todd-Hewittbuljong (Oxoid, Mexiko) eller lyofiliserades i 7.5% hästglukoserum.
DNA-extraktion
alla kulturer odlades på tryptisk sojaagar vid 30 CCR under 18 h. det genomiska DNA för varje stam erhölls genom Instagenmatris (BioRad CCR, Mexiko) enligt instruktionerna från tillverkaren. DNA-renhet och kvantitet bestämdes med användning av Ampli Quant aq-07 spektrofotometern. DNA lagrades vid -20 c-c tills användning.
STX1 och stx2 PCR-Amplifieringar
närvaron av stx1 och stx2 från DNA av OMVs och genomiskt DNA detekterades genom enstaka PCR-reaktioner med användning av primers STX1F/STX1R och STXF/STXR med en 144 respektive 217 bp-produkt, dessa primers utformades baserat på sekvensen av subenhet A. primrarna, reaktionen och förstärkningsbetingelserna bearbetades som tidigare beskrivits av Hern Acigndez-Cortez et al. (2013), med de positiva (E. coli O157:H7) och negativa (E. coli K12) kontrollerna.
DNA-sekvensering
Polymeraskedjereaktionsprodukter renades med användning av ett PureLink Quick Gel Extraktionssats (Invitrogen Kubi, Mexiko) enligt tillverkarens instruktioner. Produkterna sekvenserades direkt på en ABI-PRISM 310 genetisk analysator (Applied Biosystems, Foster City, CA, USA) med användning av framåt-och bakåtprimrar som används för PCR, enligt tillverkarens instruktioner. Sekvensering utfördes vid Instituto de biolog Cuba, UNAM (Mexiko). Sekvensanalys utfördes med det grundläggande sökverktyget för lokal anpassning (BLAST) som tillhandahålls av National Center for Biotechnology Information (NCBI).
microplate Vero Cells Preparations
denna procedur utfördes i 96-brunnsmikroplattor med Vero (ATCC Ccl81) cellmonoskikt med 80% sammanflöde, vilket tillförde minimalt väsentligt medium (MEM; Invitro Kubi, Mexiko) kompletterat med 10% v/v fetalt bovint serum (FBS; Invitro Kubi, Mexiko).
cellsuspensionen homogeniserades och justerades till 105-106 celler/mL med användning av en Neubauerkammare. Efter justering deponerades suspensionen i 200-oksl brunn. Mikroplattorna inkuberades vid 37 CCC under 5% CO2 för 24 timmar (CO2-inkubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
cellfria bakteriepreparat
fem kolonier från varje blodagarplatta inokulerades i 3 mL Craig-medium (0,4% jästextrakt, 3% casaminosyror, 0,05% K2HPO4). Dessa inkuberades för 24 timmar vid 37 C och den optiska densiteten hos den använda bakteriekulturen var 0,25 vid 600 nm. Cellfria preparat gjordes genom centrifugering av kulturerna vid 14 000 g under 10 min vid 4 ci, följt av filtrering av supernatanten genom ett membranfilter (porstorlek 0,45 pm, Sartorius Minisart NML). Cellfria supernatanter lagrades vid -20 kub C. totalt 66 cellfria bakteriepreparat erhölls på detta sätt; den positiva kontrollen (E. coli O157:H7) och den negativa kontrollen (E. coli K12) erhölls också på samma sätt (Giono-Cerezo et al., 1994).
cytotoxisk analys och LD50-bestämning
det cellfria filtratet (20 ci cl) inokulerades i brunnar innehållande celler och respektive tillväxtmedium utan antibiotika. Inokulerade celler inkuberades i 96 timmar vid 37 CCI med 5% CO2 och observerades var 24: e timme på det inverterade mikroskopet. Den cytotoxiska effekten förväntades uppträda som avrundning och krympning av celler med tjock granulering och slutligen progressiv och irreversibel förstöring av monoskiktet. Alla tester utfördes i två exemplar; livskraftskontroller med MEM och Craig medium utfördes också (Giono-Cerezo et al., 1994).
LD50 bestämdes i Aeromonas-stammar som detekterades som positiva för att orsaka cytotoxisk skada i Vero-celler. En standard 96-brunnsmikroplatta med Vero-celler bereddes som anges i 2.6, men mediet ändrades till 100 Aci l MEM med 1% BFS. Denna beredning utsattes för 100 ci l cellfri bakterieberedning, och seriella utspädningar gjordes på hela raden av plattor. Efter 24 h inkubation vid 37 CCC med 5% CO2 bestämdes LD50 under det inverterade mikroskopet. LD50 tilldelades brunnen där 50% av Vero-cellerna skadades och 50% skadades (Marques et al., 1986).
blockad-och Toxinneutraliseringsanalys
toxinneutraliseringsanalysen utfördes i de stammar som inducerade cytotoxisk skada i Vero-celler eftersom denna skada indikerar Stx. För detta test framställdes en mikroplatta med Vero-cell odlad till en sammanflöde av 90-100% med LD50 för varje cellfri bakteriepreparat. För att utföra neutraliseringsanalysen för att visa cellskador som producerats som en följd av Stx-verkan användes två monoklonala antikroppar (Universidad Nacional Aut Asicgnoma de m Sicgixico) erhållna från E. coli O157:H7.
För varje AB gjordes en Bradford-proteinkvantitation enligt tillverkarens instruktioner (Biorad), med ett resultat av 78,2 respektive 74,8 ug/UGL av anti-Stx1 respektive anti-Stx2 A. Den koncentrerade Ab bearbetades och en dubbel utspädning av AB. Därefter inkuberades 10 ci l av Ab (anti-STX1 eller anti-STX2) med 190 ci l av den cellfria supernatanten i en koncentration av LD50 för 1 h vid 37 C. Efter detta inokulerades 200 ci l av den senare i Vero-celler vid 90% av sammanflödet och inkuberades för 24 h vid 37 c c med 5% CO2 (Marques et al., 1986).
Omvs-upphandling och DNA-extraktion från Omvs
yttre membranblåsor erhölls från Aeromonas hydrophila F-0050. Protokollet utfördes som tidigare beskrivits av Guerrero-Mandujano et al. (2015a).
OMVs-DNA erhölls genom Instagenmatris (BioRad Kubi, Mexiko) enligt instruktionerna från tillverkaren. Därefter renades OMVS DNA med DNA-extraktionsfenol-kloroformteknik (Guerrero-Mandujano et al., 2015b).
resultat
STX1-och stx2-Gen PCR-Amplifieringar
polymeraskedjereaktionsscreening av 66 kliniska Aeromonas-stammar visade att 22/66 (33,3%) stammar innehöll stx1-genen, 42/66 (63,6%) stammar innehöll båda generna, inga stammar innehöll endast stx2-genen och 2/66 (3%) stammar var negativa för båda generna.
DNA-sekvensering
BLASTn-analys visade en likhet på 79 till 99% och ett förväntat värde på 3e-16/2e-97 mellan stx-1/stx-2-generna av E. coli O157:H7 och amplicon från Aeromonas spp., stam.
cytotoxisk analys och LD50-bestämning
cytotoxicitetstestet som utfördes i Vero-cellkulturer visade att 17/66 (25,7%) cellfria bakteriepreparat orsakade cytotoxisk skada, vilket tyder på produktion av en aktiv Stx (Figur 1), avslöjad av den karakteristiska skada som orsakats av Stx.
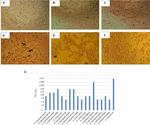
figur 1. Cytotoxicitetsanalys och LD50-bestämning utförd i Vero-cellkulturer. A) Vero-cellodling med minimalt väsentligt Medium (Viability test). B) Vero cellkultur med Craig Medium (Viability test). C) negativ kontroll med E. coli K12. (D) positiv kontroll med E. coli O157: H7, cytotoxisk skada visas (pilar) genom förstörelse av cellmonoskiktet och ”gammal spets” – effekt. (E) cytotoxisk skada av A. hydrophila f-0050 stam. F) cytotoxisk skada på A. caviae 421423 stam. (G) grafisk representation av LD50-titern för alla stammar.
resultaten för bestämning av LD50-titern var följande: 6/17 (35,2%) cellfria bakteriepreparat presenterade en titer på 1:16; 5/17 (29,4%) cellfria bakteriepreparat avbildade en titer på 1:8; 3/17 (17,6%) cellfria bakteriepreparat hade en titer på 1:64; 2/17 (11,7%) cellfria bakteriepreparat med en titer på 1:32; och 1/17 (5,8%) cellfria bakteriepreparat med en titer på 1:256 (figur 1g).
Toxinneutralisering
tillämpningen av anti-STX1 Ab i 11/17 (64.7%) stammar skadorna på celler i supernatanten hämmades fullständigt vid 39,1 mikrogram/mikrogram AB-koncentration; i 4/17 (23,5%) cellfria bakteriepreparat observerades minskad cellskada vid samma koncentration; och i 2/17 (11,7%) cellfria bakteriepreparat hämmades cellskador fullständigt vid en koncentration 78,2 mikrogram/mikrogram. Med användning av Ab anti-STX2 visade att i 9/17 (52,9%) cellfria bakteriepreparat hämmades cellskador helt vid 37,4 cu/cu och 6/17 (35,2%) cellfria bakteriepreparat visade minskad cellskada vid samma koncentration; och i 2/17 (11.7%) cellfria bakteriepreparat, cellskador hämmades fullständigt med en Ab-koncentration av 74,8 ugg/UGL (figurerna 2 och 3).

figur 2. Hämning av cytotoxisk effekt inducerad i Vero-cellodling genom cellfria bakteriepreparat av Aeromonas spp. stammar som bär stx1-eller stx2-genen.
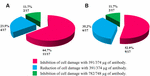
figur 3. Procent av stammar som visade hämning eller minskning av cellskador. (A) neutralisering med anti-Stx1 AB. (B) neutralisering med anti-Stx2 AB.
STX1-Gen PCR-Amplifieringar från omv
polymeraskedjereaktion av omv: s DNA av A. hydrophila F-0050 avslöjade att omv: erna innehöll genen stx1; därför kan omv: er vara ett potentiellt medel för överföring av horisontella virulensgener (Figur 4).
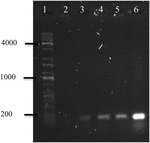
figur 4. Elektroferogram av stx1-genförstärkning från OMVS DNA. (1) kapa universell Stege, (2) negativ kontroll, (3) omv av A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) omv av E. coli O157:H7 och (6) E. coli O157:H7.
diskussion
släktet Aeromonas, som producent av Stx, kan vara en framväxande patogen som orsakar diarre främst hos pediatriska patienter (Hern Asicndez-Cortez et al., 2011; Figueras och Baez-Hidalgo, 2014). Ändå har detta släkte blivit mer relevant inom det medicinska området, eftersom det är en patogen som orsakar HUS (San Joaqu Ubign och Pickett, 1988; Bogdanovi Ubic et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
i denna studie fann vi, genom PCR-förstärkning av stx1-och stx2-generna, att 22/66 (33.3%) av aeromonad-stammarna innehöll stx1-genen, 42/66 (63,6%) stammar innehöll båda generna, och det fanns inga stammar innehållande stx2 ensam. Detta kan leda oss att föreslå att denna gen distribueras i stor utsträckning i Aeromonas-stammarna isolerade från pediatriska patienter och att dessa patienter kan vara i riskzonen för att utveckla HUS.
det finns bara en tidigare rapport där stx-generna studerades i Aeromonas-stammar isolerade från olika sjukhus i Spanien; de erhållna resultaten var att 19/80 (23,7%) stammar hade stx1-genen och endast 1/80 (1.25%) stam var positiv för båda generna (Alperi och Figueras, 2010). Dessa resultat förmedlar att det finns en större fördelning av genen i mexikanska stammar; vi bör dock ta hänsyn till att Aeromonas-släktet i Spanien är en känd gastrointestinal patogen som rutinmässigt isoleras hos patienter med en gastrointestinal profil, därför ges en adekvat behandling för att konfrontera detta släkt.
i Mexiko ingår inte detta släkt i listan över patogener som orsakar diarre och det isoleras inte rutinmässigt; som ett resultat är det svårt att ge någon behandling och god livskvalitet till patienter, dessutom finns det ingen statistik om dess prevalens. Dessutom blir släktet mer relevant på grund av de socioekonomiska förhållandena i den mexikanska befolkningen, som inkluderar vattenbrist; detta underlättar överföringen och ökar möjligheten att HUS blir ett folkhälsoproblem.
sekvensering av amplikonerna utfördes och en Sprängsökning utfördes, vilket visade 79-99% likhet och ett förväntningsvärde på 3e-16/2e-97 mellan gener stx1/stx2 jämfört med E. coli O157:H7.
LD50 bestämdes för att utvärdera den cytotoxiska skadan i Vero-cellkulturen; med denna parameter och baserad på Marques et al. (1986), kan stammarna grupperas i låg (2 101-6 102-6 102), måttlig (103-104) och hög (105-108) produktion (figur 1g). Marques et al. (1986) genomförde en studie där de gjorde en liknande analys som den i den aktuella studien, men med olika stammar av STEC fick de att 262/400 (63%) stammar grupperades som låga STX-producenter och 48% producerade cytotoxisk skada; i 40% av dessa stammar hämmades emellertid den cytotoxiska skadan med anti-Stx-antikroppar.
i den aktuella studien orsakade 25,7% av bakteriefria preparat cytotoxiska skador som är karakteristiska för Stx i Vero-celler, vilket tyder på produktion av aktiv Stx, alla Aeromonas-stammar grupperades som låga producenter av Stx; emellertid hämmades cellskadorna hos 50-70% av de cellfria supernatanterna, och hos 20-30% av cellfria supernatanter reducerades cellskadorna (Figur 3). De cellfria supernatanterna i vilka cellskador reducerades detta kunde ha varit på grund av två varianter i toxinet som finns i supernatanten, följaktligen, eftersom de är olika immunologiskt, kunde Stx inte helt hämmas och cellskadorna förblev (Marques et al., 1986).
två tidigare studier (Haque et al., 1996; Alperi och Figueras, 2010) erhöll 10,2% respektive 10,53% av Stx1-producerande Aeromonas-stammar. Orsaken till en högre andel av Aeromonas-stammar som producerar aktiv Stx kan bero på den höga tillgängligheten av Stx-bakteriofag inuti kulturen, eftersom vissa STEC-stammar bärare av Stx-bakteriofag har isolerats från urbana avloppsvatten från reningsverk, avloppsvatten från slakterier och boskapsstolar (Garc Aljaro et al., 2004, 2009). På liknande sätt har transduktionsstudier genomförts in vivo med Stx-fager från E. coli, som kan infektera tarmmikrobiotabakterier, vilket ger den toxigena egenskapen till stammar som inte infekterades tidigare (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Detsamma kan hända med släktet Aeromonas när man inducerar en gastrointestinal profil, följt av det faktum att släktet Aeromonas har förmågan att fånga och integrera virulensfaktorer i sitt genom, och en av dessa är Stx-kodande genen.
resten av stammarna orsakade cytotonisk skada i cellen, vilket möjligen tyder på produktion av andra toxiner än Stx, eftersom Aeromonas är ett släkt som kan producera två cytotoniska enterotoxiner, termostabila (AST) och termolabila (ALT) (Figueras och Baez-Hidalgo, 2014), som kan orsaka cytotonisk skada i Vero-celler; en annan möjlighet är att Aeromonas-stammarna har mer än en bakteriofag införd i deras Genom, eftersom det har visat sig att STEC-stammar med dubbel lysogeni kan reglera bakteriofager för att hämma kapaciteten hos lytisk cykelinduktion, vilket resulterar i en minskning av STX-produktionen men utan att förlora genen (Garc Cuba-aljaro et al., 2004; Imamovic och Muniesa, 2011). Därför är det nödvändigt att fastställa hur många bakteriofager innehåller Aeromonas-stammar, inklusive i föreliggande studie, för att kunna korrelera närvaron av Stx-bakteriofager och den mängd som produceras av Stx.å andra sidan representerar närvaron av Stx-bakteriofager i inducerbara Aeromonas en horisontell överföringsmekanism för stx-genen, men den är inte den enda. I nyare studier har det fastställts att Aeromonas kan producera omv (Guerrero-Mandujano et al., 2015a) och dessa omv: er kan transportera integrerat DNA (Guerrero-Mandujano et al., 2015b). I den aktuella studien förstärkte vi stx1-genen från DNA extraherat från omv: erna av en A. hydrophila-stam av kliniskt ursprung, vilket inducerade cytotoxisk skada i Vero-celler, och denna skada hämmades med anti-Stx-antikroppar. Detta indikerar att STX-bakteriofagen är transportmekanismen för stx-genen; dessutom kan OMVs och det nyligen kallade transportsystemet Typ 0 sprida stx-genen interspecies eller intraspecies. Det är dock nödvändigt att bekräfta om genen i OMVs är fullständig. Resultaten som erhållits i denna studie stöder hypotesen att stx-genen är en annan förmodad virulensfaktor för Aeromonas som kan överföras genom Omvs. Det kan representera en annan mekanism för horisontell transport av stx-genen till andra Aeromonas-stammar och/eller andra bakteriegener.
av denna anledning bör detta släkt inkluderas som möjligt orsakande medel för gastroenterit när man försöker identifiera orsaksmedel och bör rapporteras som en del av standardhälsoövervakningsförfaranden.
Författarbidrag
IP-M och AG-M utförde experimenten och MR-R utförde bioinformatikanalyserna och utarbetade manuskriptet; CH-C designade primern; VB-G och JM-L kommenterade kritiskt och reviderade manuskriptet; GC-E tänkte studien, deltog i dess design och samordning, bedömde data och utarbetade manuskriptet. Alla författare läste och godkände det slutliga manuskriptet. Vi vill tacka Sofia Marteli Mulia för att vänligt korrigera manuskriptets stil.
Finansieringen
GC-E och VB-G fått stöd från Estímulos al Desempeño sv Investigación och Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) och Sistema Nacional de Investigadores (SNI, CONACyT). Denna studie finansierades av sekretariatet för forskning och forskarutbildning vid National Polytechnic Institute (SIP 20160609). SIP-IPN var inte involverad i utvecklingen av studiedesignen, insamling, analys och tolkning av data, i skrivandet av rapporten eller i beslutet att lämna in papperet för publicering. IP-M och AG-M hade ett stipendium från CONACyT och BEIFI.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
erkännanden
Vi tackar Dr Patricia Arzate Barbosa för att tillhandahålla stamisolat och Dr Armando Navarro för att tillhandahålla monoklonala antikroppar.
förkortningar
Ab, antikropp; HUS, hemolytiskt uremiskt syndrom; INP, Instituto Nacional de Pediatria Mexico; LD50, median dödlig dos; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Humana isolat av Aeromonas har shiga-toxingener är (stx1 och stx2) mycket lik de brovirulenta genvarianterna av Escherichia coli. Clin. Mikrobiol. Infektera. 16, 1563-1567. doi: 10.1111 / j. 1469-0691. 2010.03203.X
CrossRef fulltext / Google Scholar
Bogdanovic, R., Biogobelji, M., Markovic, M., Nikolic, V., Ognjanovi, M., Sarjanovi, L., et al. (1991). Hemolytiskt uraemiskt syndrom associerat med Aeromonas hydrophila enterocolit. Pediatr. Nephrol. 5, 293-295. doi: 10.1007
CrossRef fulltext | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hern Ubigndez-Rodr Ubiguez, C. H., Rodriguez-Chacon, M., Soler, F. L., et al. (2002). Släktet Aeromonas > en viktig patogen i Mexiko? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Ormbunke Ubigndez-rend Ubign, E., Aparicio, G. O., et al. (2003). Karakterisering av Aeromonas spp. isolerad från fryst fisk avsedd som livsmedel i Mexiko. Int. J. Livsmedelsmikrobiol. 84, 41–49. doi: 10.1016 / S0168-1605 (02) 00393-8
CrossRef fulltext | Google Scholar
Fang, JS, Chen, JB, Chen, WJ och Hsu, kt (1999). Hemolytiskt ureemiskt syndrom hos en vuxen man med Aeromonas hydrophila enterocolit. Nephrol. Ringa. Transplantation. 14, 439–440. doi: 10.1093 / ndt / 14.2.439
CrossRef fulltext / Google Scholar
Figueras, MJ och Baez-Hidalgo, R. (2014). ”Aeromonas”, i Encyclopedia of Food Microbiology, eds C. A. Batt och M. L. Tortorello (Cambridge, MA: akademisk Press), 24-30.
Gamage, S. D., Strasser, J. E., krita, C. L. och Weiss, A. A. (2003). Nonpatogenic Escherichia coli kan bidra till produktionen av shiga toxin. Infektera. Immun. 71, 3107–3115. doi: 10.1128/IAI.71.6.3107-3115.2003
CrossRef fulltext / Google Scholar
Garc Cuba-Aljaro, C., Muniesa, M., Jofre, J. och Blanch, A. R. (2004). Förekomst av stx2-genen i koliforma populationer från vattenmiljöer. Appl. Miljö. Mikrobiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef fulltext / Google Scholar
Garc Cuba-Aljaro, C., Muniesa, M., Jofre, J. och Blanch, A. R. (2009). Genotypisk och fenotypisk mångfald bland inducerade, stx2-bärande bakteriofager från miljömässiga Escherichia coli-stammar. Appl. Miljö. Mikrobiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef fulltext / Google Scholar
Giono-Cerezo, S., Rodr Ubiguez-Ubigngeles, M. G., Rodr Ubiguez-Cadena, M. J. och Valdespino-g Ubicmez, J. L. (1994). Identifiering av enterotoxiner och cytotoxiner av Escherichia coli genom vero-cellkultur och fastfashybridisering (colony blot). Rev Latinoam. Mikrobiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., L Ubicpez-Villegas, E. O., Longa-Brise Ubigo, A. och Castro-Escarpulli, G. (2015a). Produktion av yttre membranblåsor i en klinisk stam av Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martmirnez, I. och Castro-Escarpulli, G. (2015b). Transportera DNA genom yttre membranblåsor av Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
Haque, QM, Sugiyama, A., Iwade, Y., Midorikawa, Y. och Yamauchi, T. (1996). Diarrheal och miljö isolat av Aeromonas spp. producera ett toxin som liknar shiga-liknande toxin 1. Curr. Mikrobiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef fulltext | Google Scholar
Hern Ubigndez-Cortez, C., Aguilera-Arreola, M. G., Ch Ubicvez-m Ubigndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A. och Castro-escarpulli, G. (2011). Genetisk identifiering av stammar av Aeromonas spp. isolerad vid National institute of pediatrics. Rev. Enfer. Infecc. Pediatrisk. 24, 157–165.
Google Scholar
Hern Ubigndez-Cortez, C., M Ubigndez-Tenorio, A., Aguilera-Arreola, M. G. och Castro-Escarpulli, G. (2013). Design och standardisering av fyra multiplex polymeraskedjereaktioner för att upptäcka bakterier som orsakar gastrointestinala sjukdomar. Afr. J. Microbiol. Res. 7, 2673-2681. doi: 10.5897 / AJMR2013. 5452
CrossRef fulltext / Google Scholar
Imamovic, L. och Muniesa, M. (2011). Kvantifiering och utvärdering av smittsamhet av shiga toxin-kodande bakteriofager i nötkött och sallad. Appl. Miljö. Mikrobiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef fulltext/Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K. och O ’ Brien, A. D. (1986). Produktion av shiga-liknande toxin av Escherichia coli. J. Infektera. Dis. 154, 338–341. doi: 10.1093 / infdis / 154.2.338
CrossRef fulltext / Google Scholar
Mauro, sa och Koudelka, GB (2011). Shiga toxin: uttryck, distribution och dess roll i miljön. Toxiner 3, 608-625. doi: 10.3390 / toxins3060608
CrossRef fulltext / Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., och Espuelas-Monge, M. (2010). Hemolytiskt uremiskt syndrom av Aeromonas: om ett kliniskt fall. Pastor Clin. Ande. 210, 206–207. doi: 10.1016 / j. cer.2009.08.002
CrossRef fulltext / Google Scholar
Robson, W. L. M., Leung, A. K. C. och Trevenen, C. L. (1992). Hemolytiskt uraemiskt syndrom associerat med Aeromonas hydrophila enterocolit. Pediatrisk. Nephrol. 6, 221–222. doi: 10.1007
CrossRef fulltext / Google Scholar
San Joaquin, VH och Pickett, Da (1988). Aeromonas-associerad gastroenterit hos barn. Pediatr. Infektera. Dis. J. 7, 53-57. doi: 10.1097 / 00006454-198801000-00013
CrossRef fulltext / Google Scholar
Schmidt, H., Bielaszewska, M. och Karch, H. (1999). Transduktion av enteriska Escherichia coli-isolat med ett derivat av shiga toxin 2-kodande bakteriofag f3538 isolerat från Escherichia coli O157:H7. Appl. Miljö. Mikrobiol. 65, 3855–3861.
Google Scholar