Muskelplasticitet
skelettmuskel är den största vävnaden i kroppen. Det är mycket plastiskt och kan genomgå dramatiska icke-patologiska svängningar i både massa och styrka som svar på en myriad av miljöpåverkan. Efter motståndsövning eller exponering för anabola steroider genomgår musklerna hypertrofi och ökar dess massa, tvärsnittsarea och styrka (Aagaard, 2004; Schiaffino et al., 2013). Samma parametrar kan minska kraftigt när musklerna initierar atrofi som svar på något av de olika förolämpningar som inkluderar: svält, denervering, immobilisering, sepsis, cancerkakexi, hjärtsvikt, diabetes, njursvikt, kronisk obstruktiv lungsjukdom och förvärvat immunbristsyndrom (Schiaffino et al., 2013).
konsekvenserna av atrofi har uppenbara konsekvenser för hälsan. Muskelsvaghet är en viktig bidragsgivare till både dödlighet och sjuklighet och är förknippad med den ökade risken för alla dödsorsaker (Metter et al., 2002). I själva verket kan minskning av muskelatrofi i cancerkakexi avsevärt förlänga livet (Zhou et al., 2010). Dessutom lider många äldre individer av sarkopeni, en långvarig muskelavfallsstörning som vanligtvis börjar efter 50 års ålder och innebär en förlust på cirka 1% av muskelmassan per år (Woo, 2017). Detta innebär att sarkopeniska individer vid 80 års ålder har förlorat cirka 40% av sin muskelmassa, en nyckelfaktor i fall, svaghet och vårdhem. Följaktligen är förståelsen av mekanismerna och potentiella terapeutiska svar på atrofi av brett grundläggande och kliniskt intresse (Ali och Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Myonukleär Domänhypotes
skelettmuskel är ganska unik genom att de mogna cellerna är syncytiala och kan innehålla hundratals kärnor. Detta är en nödvändig anpassning med tanke på att enskilda muskelfibrer kan vara enorma och uppnå längder på upp till ~600 mm (23 tum) (t.ex. sartorius muskel; Yang et al., 1998) och volymer som kan vara mer än 100 000 gånger större än en typisk mononukleerad cell (Bruusgaard et al., 2003). Bidragen från flera kärnor krävs för att producera stora mängder mRNA som behövs för att styra den enorma proteinsyntesen som krävs för att generera och upprätthålla kontraktilapparaten (Nevalainen et al., 2013).
både muskelens plastkaraktär och dess syncytiala organisation har gett upphov till en kontrovers som bara nyligen verkar ha lösts—”myonukleära domänhypotesen” (Qaisar och Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Denna teori har sitt ursprung i begreppet ”Wirkungssph Ukrre” eller ”inflytningsfält” som föreslagits av Strassburger (1893), där han hävdade att en kärna endast kan stödja en diskret volym cytoplasma och därmed definiera de övre gränserna för cellstorlek. Denna princip utarbetades ytterligare av Gregory (2001) som hävdade att cellulär deoxiribonukleinsyrahalt och volym är tätt kopplade. Skelettmuskelns syncytiala natur hjälper dessa celler att övervinna denna begränsning. Den myonukleära domänhypotesen dikterar att för att upprätthålla det korrekta kärn-till-cytoplasmiska förhållandet tillsätts nya kärnor under hypertrofi och förloras med atrofi.
det finns betydande data som visar att kärnantalet ökar med muskelhypertrofi (Moss, 1968; Cabric och James, 1983; Egner et al., 2016), även om vissa kontroverser kvarstår (Murach et al., 2018). Denna process har varit ett område med intensiv undersökning och några av de underliggande molekylära mekanismerna som reglerar förvärvet av nya kärnor under hypertrofi har definierats nyligen (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Dessa supernumerära kärnor förvärvas när stamceller, vanligtvis satellitceller, smälter samman med muskelfibrer och bidrar med sina kärnor (Brack och Rando, 2012; Bachman et al., 2018). Satellitceller bor under källarmembranet och ligger an mot sarcolemma (Katz, 1961; Mauro, 1961). De förblir vilande tills de stimuleras av antingen anabola steroider som testosteron eller genom fokalskada efter motståndsövning, vid vilken tidpunkt de återinträder cellcykeln och sprider sig (Joubert och Tobin, 1995; Abreu et al., 2017). Några av dottercellerna smälter samman med muskelfibern och underlättar både reparation och tillväxt, medan andra arresterar och rekonstituerar satellitpoolen (Dumont et al., 2015; Goh och Millay, 2017). De återstående överskottscellerna genomgår apoptos (Schwartz, 2008).
den kontroversiella aspekten av myonukleär domänhypotes är påståendet att myonuklei går förlorade under atrofi. Det finns många ingrepp som inducerar atrofi i djurmodeller, inklusive: immobilisering, denervering och sepsis (Fitts et al., 1986; Minnaard et al., 2005; O ’ Leary et al., 2012). I varje fall finns det en nettoförlust av både muskeltvärsnittsarea (den primära analysen) och utseendet av apoptotiska celler i vävnaden (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). I dessa studier mäts apoptos i en mängd olika metoder, inklusive kaspasaktivering, mitokondriell Endogfrisättning eller DNA-fragmentering . Dessa studier ger övertygande data om att apoptos ökar dramatiskt under den tidiga fasen av atrofi. Till exempel i en nyligen omfattande studie (Guo et al., 2012), Guo et al. utsatt möss till 14 dagar av baklimb suspension, en behandling som resulterade i en ~69% minskning av muskel våt vikt och en ~43,8% minskning av tvärsnittsarea i förhållande till den omanipulerade kontralaterala muskeln. Författarna kvantifierade också ett antal apoptosmarkörer, inklusive TUNELFÄRGNING, kaspas-3 klyvning/aktivering och klyvning av poly(adenosindifosfatribos) polymeras (PARP), ett protein involverat i DNA-reparation. Var och en av dessa apoptosåtgärder ökade signifikant efter baklimb-suspension. Medan det primära fokuset på detta dokument var att utvärdera den positiva effekten av elektrisk stimulering på att begränsa atrofi efter en förolämpning, tolkar de och många andra forskare dessa typer av data som ett starkt stöd för myonukleär domänhypotes.
ur ett cellbiologiskt perspektiv presenterar den presumptiva förlusten av kärnor i en syncytialvävnad som skelettmuskel ett stort praktiskt problem. Hur kan en enskild kärna bli så komprometterad att dess genom snabbt kondenserar och fragment medan dess grannar kvarstår och hjälper till att upprätthålla muskelfiberns livskraft? Med tanke på att apoptos vanligtvis medieras av aktiveringen av klassen av cysteinproteaser som kallas caspaser, är det inte klart vilken mekanism som kan tjäna till att begränsa aktiviteten hos ett diffusibelt proteas inom en vanlig cytoplasma.
denna fråga har tagits upp indirekt i en annan syncytialcellstyp, den mänskliga syncytiotrofoblasten, en vävnad som omger placentan och innehåller cirka 5 ml 1010 kärnor (Mayhew et al., 1999). När apoptos induceras i syncytiotrofoblasten sprids den som en våg med en hastighet av cirka 5 mikron per minut tills hela vävnaden är involverad (Longtin et al., 2012). Följaktligen finns det inga” privilegierade ” regioner inom den syncytiala cytoplasman och alla kärnorna förstörs slutligen.
en av de viktigaste utmaningarna med att analysera apoptos i skelettmuskel är att det är en mycket heterogen vävnad, där ungefär hälften av dess kärnor ligger utanför muskelfibrer (Schmalbruch och Hellhammer, 1977). Dessa mononukleära celler inkluderar satellitceller, endotelceller, fibroblaster, pericyter och makrofager (Tedesco et al., 2010). Följaktligen är det mycket svårt att bestämma vilken sida av sarcolemma, en kärna finns, och därmed om det är en sann myonukleus.
in vivo Time-Lapse Imaging av märkta Musmuskelfibrer
trots det stora antalet papper som visar apoptos under muskelatrofi har flera författare ifrågasatt dessa resultat (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen och Bruusgaard, 2008; Duddy et al., 2011; Qaisar och Larsson, 2014). Till exempel, med användning av isolerade muskelfibrer in vitro, Duddy et al. noterade att medan muskelfibervolymen minskade över tiden, reflekterande av en atrofisk process, verkade antalet myonuklei vara stabilt (Duddy et al., 2011).
i en serie eleganta experiment injicerade Gundersen lab individuella extensor digitorum longus (EDL) eller soleus muskler muskelfibrer med färgämnen som oberoende märkte kärnorna och cytoplasman i bedövade möss (Bruusgaard och Gundersen, 2008; Bruusgaard et al., 2010). Detta gjorde det möjligt för dem att identifiera varje kärna inom enskilda muskelfibrer in vivo över tiden och sedan utvärdera dess öde. Till exempel inducerades EDL-muskler till hypertrofi genom ablation av deras stora synergister (Bruusgaard et al., 2010). Mellan dagarna 6 och 11 ökade antalet myonuklei med cirka 54% och mellan dagarna 9 och 14 ökade tvärsnittsarean med 35% (Figur 1). Dessa data överensstämmer med hypotesen att muskler förvärvar supernumerära kärnor före den stora tillväxten av fibern under hypertrofi.

Figur 1. Myonuklei förvärvas under hypertrofi men förloras inte under atrofi hos mus. Mikrografer av samma EDL-muskelfiber över tiden efter induktion av hypertrofi (översta raden) och efterföljande induktion av atrofi (nedre raden). Fluorescerande märkta oligonukleotider användes för att visualisera kärnorna in vivo. De streckade linjerna representerar sarcolemma. Skala bar = 50 kubm. (Anpassad från Bruusgaard et al., 2010. Används med tillstånd av Proceedings of the National Academy of Sciences.)
de undersökte sedan ödet för dessa unikt identifierbara myonuklei i samma muskelfibrer när de inducerades att genomgå atrofi. Denervering ledde till en cirka 50% minskning av muskelfibervolymen, men ingen förlust av myonuklei (Figur 1; Bruusgaard et al., 2010). Misslyckandet med att observera kärnförlust berodde inte på den atrofiska stimulansen som användes eftersom de fick samma resultat när musklerna inducerades till atrofi som svar på tetrodotoxininducerad nervblockad, baklimb-suspension, cancerkakexi eller detraining (Bruusgaard och Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). Faktum är att de under sina studier undersökte mer än 200 000 individuella myonuklei i atrofiska muskler och observerade endast 4 TUNEL-positiva (apoptotiska) kärnor, vilket representerar en förlust av endast ~0,002% av kärnorna (Bruusgaard et al., 2012). Dessa data stöder starkt hypotesen att skelettmuskelatrofi inte åtföljs av myonukleär död.
Insektsmuskel som en modell
lika kraftfull som dessa studier är, finns det vissa begränsningar som är inneboende med användningen av däggdjursmodeller. Först förlitar de sig alltid på experimentella ingrepp som denervering för att inducera muskelatrofi. För det andra används den kontralaterala muskeln vanligtvis som en intern kontroll även om den också utsätts för några av samma Miljösignaler, såsom stresshormoner (Bonaldo och Sandri, 2013). Slutligen kan skelettmuskler också genomgå programmerad celldöd (PCD) under utveckling, och dessa modeller tar sällan upp apoptosens roll i dessa celler.
en alternativ modell som inte lider av någon av dessa begränsningar och tillåter studier av muskelkärnor under både atrofi och naturligt förekommande PCD, är den intersegmentala muskeln (ISM) från tobakshökmoth Manduca sexta. ISMs består av ark av jätte muskelfibrer, där varje cell är cirka 5 mm lång och upp till 1 mm i diameter (figur 2a). ISMs fäster vid segmentgränserna i buken och genererar både larvernas krypningsbeteende och den vuxna Malens eklosion (uppkomst) beteende när den flyr från pupalkutiklet i slutet av metamorfos.
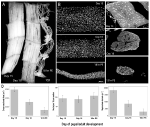
Figur 2. Retention av myonuklei under både atrofi och död av de intersegmentala musklerna (ISMs) från Mal Manduca sexta. (A) ISMs från tre utvecklingsstadier: homeostatisk (dag 15 av pupal-vuxenutveckling; vänster); atrofisk (dag 18; mitten); och döende (18 h efter eklosion; höger). Skala bar lika ~1 mm (anpassad från Schwartz et al., 2016). (B) ISMs från samma utvecklingsstadier rensades och färgades med kärnfärgen DAPI och visualiserades via konfokal mikroskopi (anpassad från Schwartz et al., 2016). (C) ISM-fibersektioner (10 mikrogram) färgades med kärnämnet DAPI. Notera den dramatiska förlusten av muskelprotein (ljusgrå yta) under atrofi och död, men retentionen av kärnor i alla steg (anpassad från Schwartz et al., 2016). (D) kvantifiering av ISM-fibervolym (vänster), kärnnummer (mitten) och myonukleär domänstorlek (höger) under homeostas, atrofi och död. (Medelvärde för standardfel för Xiaomi.) (Anpassad från Schwartz et al., 2016).
på dag 15 av de normala 18 dagarna av pupal-vuxenutveckling initierar ISMs ett hormonellt utlöst program av atrofi som resulterar i en 40% förlust av massa vid tiden för eklosion 3 dagar senare (figur 2a; Schwartz och Truman, 1983). Denna dramatiska förlust av muskelmassa motsvarar den som ses hos 80-åriga individer med sarkopeni, men äger rum över 3 dagar snarare än 30 år. Medan ISMs förlorar massa behåller de normala fysiologiska egenskaper som vilopotential och kraft/tvärsnittsarea (Schwartz och Ruff, 2002). ISMs används för att generera eklosionsbeteendet i slutet av dag 18 och sedan initiera PCD, som båda utlöses av ett peptidhormon (Schwartz och Truman, 1982, 1983). .
i motsats till däggdjursmuskler innehåller ISMs inte kapillärer, satellitceller, endotelceller eller pericyter, vilket innebär att praktiskt taget alla kärnor i vävnaden ligger inom muskelfibrerna själva (Beaulaton och Lockshin, 1977). Vi använde två oberoende metoder för att övervaka kärn öde under både atrofi och död i denna modell (Schwartz et al., 2016). Den första var en standard anatomisk inställning. När ISMs genomgår atrofi och död finns det dramatiska minskningar i både fibrernas volym och tvärsnittsarea, men grovt var kärnantalet oförändrat (Figur 2B). Med hjälp av sektionerade vävnader för kvantitativa studier fann vi att det fanns en ~49% minskning av fiberns tvärsnittsarea under atrofi och ytterligare 30% minskning under de tidiga dödsfasen (figurerna 2C,D; Schwartz et al., 2016). Antalet kärnor förändrades emellertid inte under samma period vilket innebar att det fanns funktionellt en 84% minskning av den myonukleära domänen.
den andra metoden vi använde var att mäta DNA-innehållet i enskilda muskelfibrer från djur på dag 13, när musklerna är homeostatiska, fram till 18 timmar efter eklosion, när musklerna är mycket degenererade (Schwartz et al., 2016). Vi kvantifierade DNA-innehållet i 420 enskilda celler och fann att det inte fanns någon signifikant förlust under utvecklingen. Dessa biokemiska analyser överensstämmer väl med de anatomiska data och tyder på att den relativa koncentrationen av både kärnor och genomiskt DNA funktionellt ökade när musklerna atrofierade och dog. Följaktligen tyder data från både möss och Malar på att muskelkärnor inte genomgår apoptos under atrofi (eller PCD) och leder till slutsatsen att den myonukleära domänhypotesen bör avvisas.
slutsatser
dessa observationer har ett antal konsekvenser för både förståelse av muskelns grundläggande biologi och för att utveckla potentiella terapeutiska ingrepp. Medan det finns betydande data som rapporterar närvaron av apoptotiska kärnor i vävnaden efter atrofiska förolämpningar, tyder de senaste uppgifterna på att dessa inte är sanna myonuklei, utan snarare fördömde mononukleära celler som ligger utanför muskelfibrerna. Den främsta orsaken till denna skillnad är att de traditionella verktygen som används för att upptäcka apoptos saknar den upplösning som krävs för att på ett adekvat sätt bestämma vilken sida av sarcolemma en döende cell finns. Metoder som märker myonuklei specifikt, antingen via in vivo-injektioner av fluorescerande färgämnen (Bruusgaard och Gundersen, 2008) eller via genetiska manipuleringar för att uttrycka markörproteiner (Duddy et al., 2011), avslöjar få om några apoptotiska kärnor inom de märkta fibrerna. Den senaste demonstrationen att antikroppar riktade mot Protein Pericentriolärt Material 1 (PCM1) etikett endast autentisk myonuklei erbjuder ett lovande verktyg som kan appliceras på de traditionella histologiska materialen som rutinmässigt analyseras i fältet (Winje et al., 2018b).
misslyckandet med skelettmuskler att använda apoptos som en mekanism för att eliminera myonuklei är inte förvånande. Det verkar som om Mogen skelettmuskel i stor utsträckning utesluts från att initiera apoptos genom att den uppreglerar uttrycket av potenta överlevnadsproteiner som X-länkad hämmare av apoptosprotein (XIAP) (Smith et al., 2009) och apoptos repressor med caspase recruitment domain (ARC) (Xiao et al., 2011), samtidigt som man uttrycker låga nivåer av apoptosmediatorer som apoptotisk proteasaktiverande faktor 1 (Apaf-1) (Burgess et al., 1999). Detta är meningsfullt teleologiskt eftersom musklerna utsätts för extrema störningar, inklusive störning av sarkolemma efter intensiv träning, så det skulle vara katastrofalt om de utlöste celldöd snarare än initierad vävnadsreparation och eventuellt hypertrofi. Liksom andra terminalt differentierade celler tenderar muskler att använda icke-apoptotiska mekanismer, särskilt autofagisk PCD (även känd som typ II degeneration) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) när de dör under utveckling.
Även om det fanns en mekanism genom vilken muskler selektivt kunde rikta sig mot enskilda kärnor, är det inte klart att detta skulle vara fördelaktigt. Faktum är att kvarhållandet av” överskott ” – kärnor under atrofi ger en distinkt fördel för individen eftersom skelettmuskler ofta genomgår cykler av atrofi och hypertrofi som svar på miljöförhållanden som mattillgänglighet. Förmågan att återhämta sig snabbt genom att använda befintliga myonuklei kan tjäna en viktig roll i anpassningen (Jackson et al., 2012) och hjälpa till att förklara fenomenet ”muskelminne” (Staron et al., 1991; Gundersen, 2016). Det är väl dokumenterat inom träningsfysiologi att det är mycket lättare att återkräva en viss nivå av muskelkondition genom träning än det var för att uppnå det första, även om det har varit en lång mellanliggande period av detraining. Med andra ord kan frasen ”använd den eller förlora den” vara mer exakt formulerad som ”använd den eller förlora den tills du arbetar på den igen.”Detta har visats direkt av ett annat experiment från Gundersen lab som visade att när en muskel har förvärvat nya kärnor behåller den dem långt efter att den hypertrofiska stimulansen har tagits bort. De inducerade muskelhypertrofi hos kvinnliga möss genom att behandla dem i 2 veckor med testosteron och undersökte sedan musklerna 3 veckor efter steroiduttag (Egner et al., 2013). Muskelvolymen hade återgått till baslinjen men de nyförvärvade kärnorna kvarstod även 3 månader senare. När musklerna utsattes för överbelastning för att återinitiera hypertrofi genomgick de steroidbehandlade snabbt en 36% ökning av fibervolymen medan kontrollmusklerna bara växte med 6%. Dessa data tyder på att kärnorna” överskott ” kan mobiliseras snabbt för att underlätta omskolning.
dessa observationer har potentiella konsekvenser för folkhälsopolitiken. Det har visats att muskeltillväxt, fysiologisk funktion och regenerativ kapacitet alla minskar med åldern, till stor del på grund av minskad satellitcellsproliferation (Blau et al., 2015). Följaktligen kan träning under tonåren, när muskeltillväxten förbättras av hormoner, näring och en robust satellitpool, funktionellt tjäna till att tillåta individer att ”banka” myonuklei som kan dras på senare i livet för att bromsa effekterna av åldrande och eventuellt förhindra sarkopeni.
dessutom har dessa data konsekvenser inom området tävlingsidrott. Användningen av anabola steroider är en potent stimulans för muskelhypertrofi och tillägg av nya myonuklei (Egner et al., 2013). Eftersom dessa kärnor kvarstår långt efter steroidanvändningen slutar, kommer idrottare sannolikt att dra nytta av olaglig narkotikamissbruk utan risk för upptäckt.
Sammanfattningsvis, medan tillsatsen av nya kärnor med muskeltillväxt till stor del accepteras, kan den apoptotiska förlusten av kärnor med atrofi inte stödjas, vilket tyder på att strikt tolkning av myonukleär domänhypotes inte kan stödjas. Istället verkar det som om myonuklei en gång förvärvats kvarstår även när en muskel blir atrofisk eller initierar celldöd.
Författarbidrag
författaren bekräftar att han är den enda bidragsgivaren till detta arbete och har godkänt det för publicering.
finansiering
arbetet för denna publikation stöddes av medel från Eugene M. och Ronnie Isenberg Professorship Endowment. Inget företagsstöd gavs till författaren och inga kommersiella produkter nämns eller godkänns.
intressekonflikt uttalande
författaren förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
erkännanden
författaren vill tacka Christine Brown för hjälp vid utarbetandet av detta manuskript och Eugene M. och Ronnie Isenberg professur Endowment för stöd.
Aagaard, P. (2004). Att göra musklerna ”starkare”: motion, näring, droger. J. Musculoskelet. Neuronal. Interagera. 4, 165–174.
PubMed Abstract / Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M. och Hirabara, S. M. (2017). Satellitcellsaktivering inducerad av aerob muskelanpassning som svar på uthållighetsträning hos människor och gnagare. Life Sci. 170, 33–40. doi: 10.1016/j.lfs.2016.11.016
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Ali, S. och Garcia, J. M. (2014). Sarkopeni, kakexi och åldrande: diagnos, mekanismer och terapeutiska alternativ—en mini-recension. Gerontologi 60, 294-305. doi: 10.1159 / 000356760
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A. och Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z. och Sieck, G. C. (2006). Denervationseffekter på myonukleär domänstorlek hos råttmembranfibrer. J. Appl. Fysiol. 100, 1617–1622. doi: 10.1152 / japplphysiol.01277.2005
CrossRef fulltext / Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). Prepubertal skelettmuskeltillväxt kräver Pax 7-Uttryckande satellitcell-härledd myonukleär bidrag. Utveckling 145: 167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M. och Dupont-Versteegden, E. E. (2015). Distinkta muskelapoptotiska vägar aktiveras i muskler med olika fibertyper i en råttmodell av kritisk sjukdom myopati. J. Muskel Res. Cellmotil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Beaulaton, J. och Lockshin, R. A. (1977). Ultrastrukturell studie av den normala degenerationen av de intersegmentala musklerna i Anthereae polyphemus och Manduca sexta (insecta, lepidoptera) med särskild hänvisning till cellulär autofagi. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a stimulerar MyoGen stamcellsmotilitet och engraftment vilket resulterar i förbättrad muskelstyrka. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Blau, H. M., Cosgrove, B. D. och Ho, A. T. (2015). Den centrala rollen av muskelstamceller i regenerativ misslyckande med åldrande. Nat. Med. 21, 854–862. doi: 10.1038 / nm.3918
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bonaldo, P. och Sandri, M. (2013). Cellulära och molekylära mekanismer för muskelatrofi. Dis. Modell. Mech. 6, 25–39. doi: 10.1242/dmm.010389
CrossRef fulltext / Google Scholar
Brack, A. S. och Rando, ta (2012). Vävnadsspecifika stamceller: lektioner från skelettmuskulaturens satellitcell. Cellstamcell 10, 504-514. doi: 10.1016/j.stam.2012.04.001
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D. och Gundersen, K. (2012). Ingen förändring i myonukleärt antal under muskelavlastning och omlastning. J. Appl. Fysiol. 113, 290–296. doi: 10.1152 / japplphysiol.00436.2012
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bruusgaard, J. C., Och Gundersen, K. (2008). In vivo time-lapse mikroskopi avslöjar ingen förlust av murin myonuklei under veckor av muskelatrofi. J. Clin. Investera. 118, 1450–1457. doi: 10.1172 / JCI34022
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bruusgaard, JC, Johansen, ib, Egner, im, Rana, za och Gundersen, K. (2010). Myonuklei som förvärvats av överbelastningsövning föregår hypertrofi och går inte förlorade vid detraining. Proc. Natl. Acad. Sci. USA 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef fulltext / Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K. och Gundersen, K. (2003). Antal och rumslig fördelning av kärnor i muskelfibrerna hos normala möss studerade in vivo. J. Physiol. 551, 467–478. doi: 10.1113 / jfysiol.2003.045328
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Humana skelettmuskelcytosoler är eldfasta mot cytokrom c-beroende aktivering av kaspaser av typ II och saknar APAF-1. Celldöd Skiljer Sig Åt. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Cabric, M. och James, N. T. (1983). Morfometriska analyser på musklerna hos tränade och otränade hundar. Är. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Cheema, N., Herbst, A., McKenzie, D. och Aiken, J. M. (2015). Apoptos och nekros förmedlar förlust av skelettmuskelfibrer i åldersinducerade mitokondriella enzymatiska abnormiteter. Åldrande Cell 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Clarke, PG (1990). Utvecklingscelldöd: morfologisk mångfald och flera mekanismer. Anat. Embryol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A. och Goldberg, A. L. (2015). Muskelavfall i sjukdom: molekylära mekanismer och lovande terapier. Nat. Rev. Drog Discov. 14, 58–74. doi: 10.1038 / nrd4467
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Duddy, WJ, Cohen, T., duguez, S. och Partridge, ta (2011). Den isolerade muskelfibern som en modell för oanvänd atrofi: karakterisering med hjälp av PhAct, en metod för att kvantifiera f-aktin. Exp. Cell Res. 317, 1979-1993. doi: 10.1016 / j. yexcr.2011.05.013
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Dumont, N. A., Wang, Y. X. och Rudnicki, ma (2015). Intrinsiska och extrinsiska mekanismer som reglerar satellitcellfunktionen. Utveckling 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E. och Gundersen, K. (2013). En cellulär minnesmekanism hjälper överbelastningshypertrofi i muskler långt efter en episodisk exponering för anabola steroider. J. Physiol. 591, 6221–6230. doi: 10.1113 / jfysiol.2013.264457
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Egner, im, Bruusgaard, JC och Gundersen, K. (2016). Satellitcellutarmning förhindrar fiberhypertrofi i skelettmuskulaturen. Utveckling 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A. och Unsworth, B. R. (1986). Modeller av disuse: en jämförelse av bakbensupphängning och immobilisering. J. Appl. Fysiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Döende neuroner i talamus av kvävda sikt nyfödda och råttor är autofagiska. Ann. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Goh, Q. och Millay, D. P. (2017). Krav på myomaker-medierad stamcellfusion för skelettmuskelhypertrofi. elife 6. doi: 10.7554 / eLife.20007
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Gregory, T. R. (2001). Tillfällighet, samevolution eller orsakssamband? DNA-innehåll, cellstorlek och C-värdet enigma. Biol. Rev. Camb. Philos. Soc. 76, 65–101. doi: 10.1017 / s1464793100005595
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). Srf-beroende parakrinsignaler som produceras av myofibrer kontrollerar satellitcellmedierad skelettmuskelhypertrofi. Cell Metab. 15, 25–37. doi: 10.1016/j.cmet.2011.12.001
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Gundersen, K. (2016). Muskelminne och en ny cellmodell för muskelatrofi och hypertrofi. J. Exp. Biol. 219, 235–242. doi: 10.1242/jeb.124495
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Gundersen, K. och Bruusgaard, J. C. (2008). Kärndomäner under muskelatrofi: kärnor förlorade eller paradigm förlorade? J. Physiol. 586, 2675–2681. doi: 10.1113 / jfysiol.2008.154369
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T. och Yeung, E. W. (2012). Elektrisk stimulering påverkar satellitcellsproliferation och apoptos vid lossningsinducerad muskelatrofi hos möss. PLoS EN 7: e30348. doi: 10.1371 / tidskrift.pone.0053523
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). Satellitcellutarmning hämmar inte återväxt av vuxna skelettmuskler efter avlastningsinducerad atrofi. Är. J. Phys. Cellfysiol. 303, C854-C861. doi: 10.1152/ajpcell.00207.2012
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Joubert, Y., och Tobin, C. (1995). Testosteronbehandling resulterar i att vilande satellitceller aktiveras och rekryteras till cellcykel i råtta levator ani muskel. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Katz, B. (1961). Avslutningarna av den afferenta nervfibern i grodans muskelspindel. Philos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
PubMed Abstract / Google Scholar
Kletzien, H., Hare, A. J., Leverson, G. och Connor, N. P. (2018). Åldersrelaterad effekt av celldöd på fibermorfologi och antal i tungmuskel. Muskelnerv 57, E29-E37. doi: 10.1002 / mus.25671
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Kole, aj, Annis, Rp och Deshmukh, M. (2013). Mogna neuroner: utrustade för överlevnad. Celldöd Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Li, T. S., Shi, H., Wang, L. och Yan, C. (2016). Effekt av benmärgsmesenkymala stamceller på satellitcellsproliferation och apoptos vid immobiliseringsinducerad muskelatrofi hos råttor. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659/MSM.898137
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Lockshin, R. A. och Williams, C. M. (1965). Programmerad celldöd-I. cytologi av degeneration i de intersegmentala musklerna i pernyi silkmoth. J. Insektfysiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Longtine, ms, Barton, A., Chen, B. och Nelson, D. M. (2012). Live-cell imaging visar apoptos initierar lokalt och förökar sig som en våg genom syncytiotrofoblaster i primära kulturer av humana placenta villösa trofoblaster. Placenta 33, 971-976. doi: 10.1016 / j. placenta.2012.09.013
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Mauro, A. (1961). Satellitcell av skelettmuskelfibrer. J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, TM, Leach, L., McGee, R., Ismail, WW, Myklebust, R. och Lammiman, MJ (1999). Proliferation, differentiering och apoptos i villös trofoblast vid 13-41 veckors graviditet (inklusive observationer om annulerade lameller och kärnporkomplex). Placenta 20, 407-422. doi: 10.1053 / plac.1999.0399.
PubMed Abstrakt / CrossRef fulltext / Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Underhåll av myonukleär domänstorlek i råtta soleus efter överbelastning och tillväxthormon/IGF-I-behandling. J. Appl. Fysiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Caspase-3-reglering av membranmyonukleär domän under mekanisk ventilationsinducerad atrofi. Är. J. Respir. Crit. Vård Med. 175, 150–159. doi: 10.1164/rccm.200601-142OC
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M. och Conwit, R. (2002). Skelettmuskelstyrka som en prediktor för dödlighet av alla orsaker hos friska män. J. Gerontol. En Biol. Sci. Med. Sci. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H. och Hesselink, M. K. (2005). Skelettmuskelavfall och kontraktil prestanda hos septiska råttor. Muskelnerv 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Moss, F. P. (1968). Förhållandet mellan fibrernas dimensioner och antalet kärnor under normal tillväxt av skelettmuskulaturen i tamfågeln. Är. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Murach, K. A., Englund, Da, Dupont-Versteegden, E. E., McCarthy, J. J. och Peterson, ca (2018). Myonukleär domänflexibilitet utmanar stela antaganden om satellitcellsbidrag till skelettmuskelfiberhypertrofi. Front. Fysiol. 9:635. doi: 10.3389/fphys.2018.00635
CrossRef fulltext/Google Scholar
Nevalainen, M., Kaakinen, M. och Metsikko, K. (2013). Distribution av mRNA-transkript och översättningsaktivitet i skelettmyofibrer. Cellvävnad Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-X
PubMed Abstrakt / CrossRef fulltext / Google Scholar
O ’ Leary, MF, Vainshtein, A., Carter, hn, Zhang, Y. och Hood, Da (2012). Denervationsinducerad mitokondriell dysfunktion och autofagi i skelettmuskel hos apoptosbrist djur. Är. J. Phys. Cellfysiol. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S. och Ochala, J. (2018). SIRT1 reglerar kärnnummer och domänstorlek i skelettmuskelfibrer. J. Cell. Fysiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B. Och Sandri, M. (2013). Mekanismer som reglerar skelettmuskeltillväxt och atrofi. FEBS J. 280, 4294-4314. doi: 10.1111/febs.12253
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Schmalbruch, H. och Hellhammer, U. (1977). Antalet kärnor i vuxna råttmuskler med särskild hänvisning till satellitceller. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Schwartz, L. M. (2008). Atrofi och programmerad celldöd av skelettmuskel. Celldöd Skiljer Sig Åt. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Schwartz, lm, Brown, C., McLaughlin, K., Smith, W. och Bigelow, C. (2016). Den myonukleära domänen upprätthålls inte i skelettmuskulaturen under antingen atrofi eller programmerad celldöd. Är. J. Phys. Cellfysiol. 311, C607-C615. doi: 10.1152/ajpcell.00176.2016
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Schwartz, lm och Ruff, rl (2002). Förändringar i kontraktila egenskaper hos skelettmuskel under utvecklingsprogrammerad atrofi och död. Är. J. Phys. Cellfysiol. 282, C1270-C1277. doi: 10.1152/ajpcell.01275.2000
CrossRef fulltext / Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E. och Osborne, B. A. (1993). Inträffar alla programmerade celldöd via apoptos? Proc. Natl. Acad. Sci. USA 90, 980-984.
Google Scholar
Schwartz, L. M. och Truman, J. W. (1983). Hormonal kontroll av metamorf utveckling i tobakshornmask Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Schwartz, L. M. och Truman, J. W. (1982). Peptid och steroidreglering av muskeldegenerering i en insekt. Vetenskap 215, 1420-1421. doi: 10.1126 / vetenskap.6278594
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A. och Bass, J. J. (2000). Nukleär DNA-fragmentering och morfologiska förändringar i skelettmuskulaturen hos vuxna kaniner efter kortvarig immobilisering. Cellvävnad Res. 302, 235-241. doi: 10.1007 / s004410000280
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Smith, M. I., Huang, Y. Y. och Deshmukh, M. (2009). Skelettmuskeldifferentiering framkallar endogen XIAP för att begränsa den apoptotiska vägen. PLoS en 4: e5097. doi: 10.1371 / tidskrift.pone.0005097
CrossRef fulltext / Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Styrka och skelettmuskel anpassningar i tungt motstånd-utbildade kvinnor efter detraining och omskolning. J. Appl. Fysiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). Kärnans verkningsfält och cellstorleken. Histol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G. och Konwalinka, G. (2000). Åldersberoende apoptos och förlust av rhabdosphincterceller. J. Urol. 164, 1781–1785. doi: 10.1016 / S0022-5347(05) 67106-6
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-manera, J., Messina, G. och Cossu, G. (2010). Reparera skelettmuskel: regenerativ potential hos skelettmuskelstamceller. J. Clin. Investera. 120, 11–19. doi: 10.1172 / JCI40373
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S. och soja, H. (2002). Ingen minskning av myonukleärt Antal efter långvarig denervering hos mogna möss. Är. J. Phys. Cellfysiol. 283, C484-C488. doi: 10.1152/ajpcell.00025.2002
CrossRef fulltext / Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbr C., A., tenn C., S., Saatcioglu, F., et al. (2018a). Kakexi inducerar inte förlust av myonuklei eller muskelfibrer under xenograftad prostatacancer hos möss. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef fulltext / Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C. och Gundersen, K. (2018b). Specifik märkning av myonuklei med en antikropp mot pericentriolärt material 1 på skelettmuskelvävnadssektioner. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef fulltext / Google Scholar
Woo, J. (2017). Sarkopeni. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016/j.cger.2010.02.012
CrossRef fulltext / Google Scholar
Xiao, R., Ferry, A. L. och Dupont-Versteegden, E. E. (2011). Celldöd-resistens hos differentierade myotubes är associerad med förbättrade anti-apoptotiska mekanismer jämfört med myoblaster. Apoptos 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Yang, D., Morris, S. F. och Sigurdson, L. (1998). Sartorius muskeln: anatomiska överväganden för rekonstruktiva kirurger. Surg. Radiol. Anat. 20, 307–310. doi: 10.1007
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Zhong, H., Roy, R. R., Siengthai, B. Och Edgerton, V. R. (2005). Effekter av inaktivitet på fiberstorlek och myonukleärt antal i råtta soleusmuskel. J. Appl. Fysiol. 99, 1494–1499. doi: 10.1152 / japplphysiol.00394.2005
CrossRef fulltext / Google Scholar
Zhou, X., Wang, J. L., Lu, J., sång, Y., Kwak, K. S., Jiao, Q., et al. (2010). Återföring av cancercachexi och muskelavfall genom Act RIIB-antagonism leder till långvarig överlevnad. Cell 142, 531-543. doi: 10.1016 / j. cell.2010.07.011
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A. och Murlasits, Z. (2017). Biokemiska vägar för sarkopeni och deras modulering genom fysisk träning: en berättande granskning. Front. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef fulltext / Google Scholar