Une maladie à transmission vectorielle (en particulier un transfert biologique plutôt que mécanique) est une maladie dans laquelle la transmission de l’infection dans une population (la population hôte) ne se produit que par l’intermédiaire d’une deuxième population (vecteurs). Les vecteurs sont généralement des arthropodes hématophages (qui se nourrissent de sang) tels que les moustiques, les phlébotomes ou les tiques. Il existe de nombreuses maladies de ce type, dont la dynamique présente un grand intérêt du point de vue du contrôle de l’infection. Le paludisme, la leishmaniose, la dengue et le virus du Nil occidental n’en sont que quelques-uns qui ont actuellement un impact social énorme sur les populations humaines.
Chaque année dans la région de 225 millions de personnes sont infectées par le parasite du paludisme et en 2009, environ 781 000 d’entre elles ont entraîné une mortalité induite par la maladie. L’histoire est similaire pour la leishmaniose où il y a environ 12 millions de personnes dans le monde qui seraient infectées à un moment donné et environ 80 000 personnes meurent chaque année de la forme la plus grave, la leishmaniose viscérale. De telles maladies sévissent dans le monde en développement; une combinaison d’un habitat optimal pour les vecteurs dans les régions tropicales et d’un manque d’aide médicale conduit à des endémies à grande échelle dans ces régions.
Les maladies humaines ne sont pas la seule préoccupation ; il y en a beaucoup d’autres qui infectent d’autres classes d’hôtes qui présentent également un intérêt, notamment du point de vue de la préservation des espèces menacées.
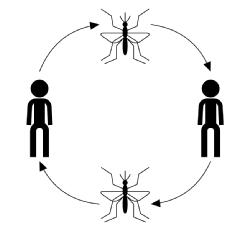
L’évolution typique de l’infection pour la transmission vectorielle, en ignorant la maladie, l’hôte ou les espèces vectorielles, commence par un vecteur infecté (un arthropode adulte qui nourrit ou suce du sang) prenant un repas de sang d’un membre sensible de la population hôte. Une fois mordu, l’hôte a une chance d’être infecté par la maladie. À ce stade, s’il est infecté, l’hôte est considéré comme exposé mais ne subit aucun effet indésirable de l’infection et ne peut pas transmettre la maladie. Le temps après l’infection mais avant de devenir infectieux est connu sous le nom de période de latence. Lorsque le parasite a atteint un certain stade de son cycle de reproduction, l’hôte devient infectieux après quoi, s’il est mordu, il peut transmettre la maladie à un vecteur sensible par son sang infecté par le parasite et terminer le cycle de transmission (illustré dans la figure ci-dessous).
La transmission de la maladie est généralement caractérisée par:
- abondance et propagation spatiale des hôtes et des vecteurs
- démographie
- un taux d’alimentation ou un désir vectoriel de mordre
- succès ou échec de la transmission
Les modèles généralement mathématiques des maladies à transmission vectorielle sont basés sur un modèle SI(R) à deux populations présentant des termes d’infection « croisés”, où et
sont la force d’infection des termes pour les hôtes et les vecteurs respectivement:
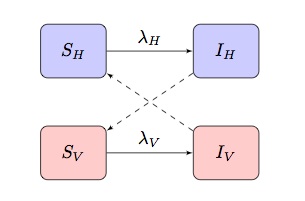
Selon la maladie et la population modélisées, cette transmission peut être adaptée pour incorporer d’autres caractéristiques plus spécifiques.
Modélisation de la dynamique des maladies à transmission vectorielle
Il existe de nombreux types de modèles mathématiques pour la transmission des maladies à transmission vectorielle; idéalement, ils sont recherchés pour être traçables mathématiquement et aussi simples que possible tout en conservant la dynamique générale du système biologique. Sans surprise, les modèles de la littérature varient considérablement; du déterministe au stochastique, endémique (y compris les taux de natalité et de mortalité) ou épidémique (une épidémie de durée limitée), intégrant la propagation spatiale, l’hétérogénéité spatiale, les périodes de latence, la structure par âge, l’acquisition et la perte d’immunité, de multiples souches et bien d’autres. Même si l’on ne considère qu’une seule maladie spécifique, les variations de la maladie au sein de différentes populations peuvent entraîner des changements non seulement dans le paramétrage, mais aussi dans la façon dont on peut souhaiter adopter l’approche de modélisation.
Une partie du travail de Kat se concentre sur les simplifications qui sont souvent faites pour réduire la complexité des modèles. Ce travail examine les effets de l’utilisation de modèles de transmission « hôte uniquement » tels que l’hypothèse du quasi-équilibre sur la dynamique de la maladie et également l’effet de l’omission de la période de latence sur les prédictions épidémiques.
Leishmaniose
À compléter par Erin
La Trypanosomiase humaine africaine (HAT)
La trypanosomiase humaine africaine (HAT), plus familièrement connue sous le nom de maladie du sommeil, est une maladie mortelle endémique dans une grande partie de l’Afrique subsaharienne. 70 millions de personnes vivent dans des zones à risque couvrant plus d’un million et demi de kilomètres carrés. Alors que la prévalence de la HAT n’est pas aussi élevée que celle d’autres maladies à transmission vectorielle telles que le paludisme ou la dengue (il y avait un peu plus de 7000 cas signalés de HAT mais 207 millions de cas estimés de paludisme en 2012), l’absence de prophylaxie chimique, le traitement extrêmement désagréable (et souvent mortel) et le manque de recherches scientiques substantielles ont maintenant placé la HAT sur la liste des maladies tropicales négligées de l’OMS.
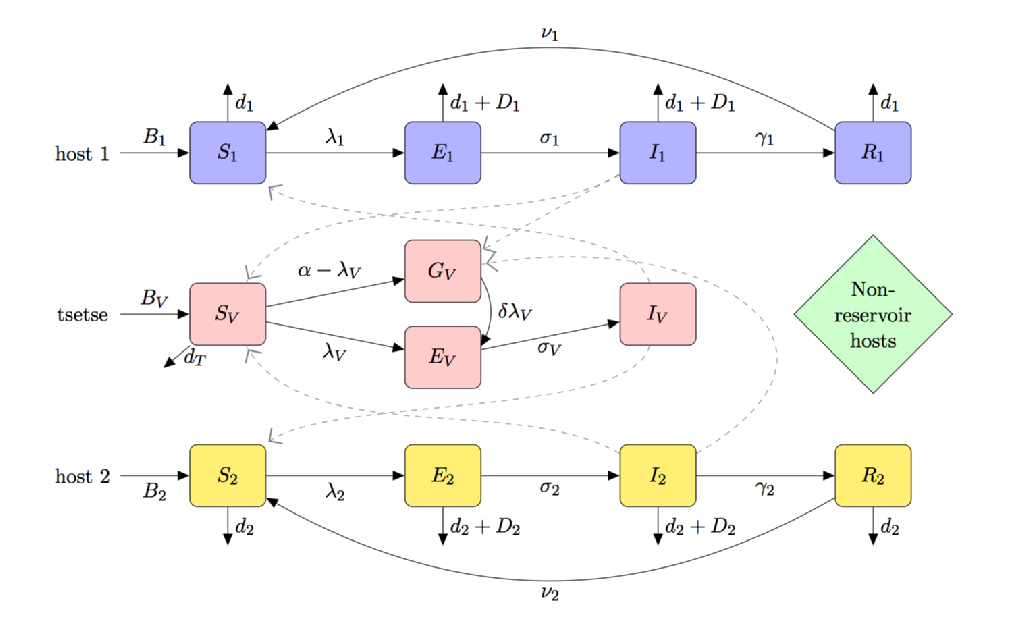
Le vecteur du CHAPEAU est la tsé-tsé; sa nécessité de se nourrir de sang pour prévenir la famine et une interaction vecteur-parasite unique (provoquant un « phénomène de susceptibilité ténérale ») signifient que la modélisation de la HAT est nettement différente d’autres maladies à transmission vectorielle telles que le paludisme.
La figure ci-dessous est une caricature compartimentée d’un modèle pour CHAPEAU qui comprend:
- Sensibilité (partielle) à la mouche ténérale
- espèces multi-hôtes (y compris les hôtes réservoirs et non réservoirs)
- préférence d’alimentation de la tsé-tsé
- famine de la tsé-tsé non nourrie
Maladie de la fièvre catarrhale (BTV)
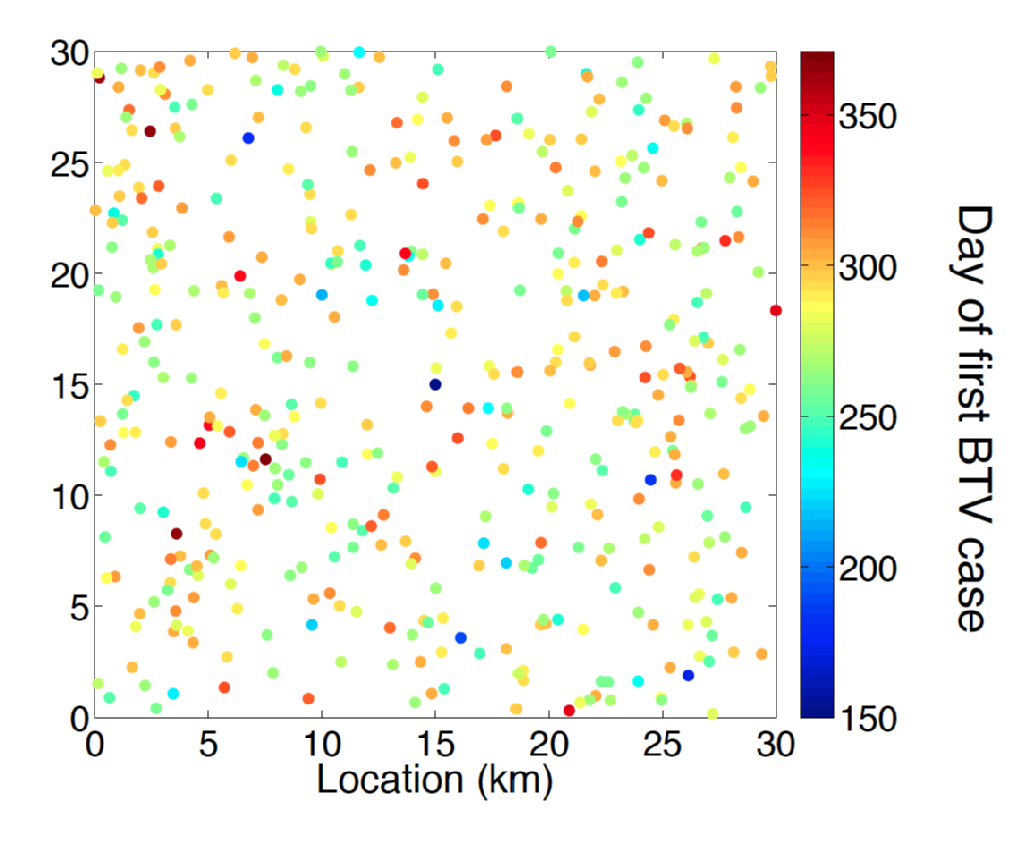
La fièvre catarrhale du mouton est une maladie virale des ruminants transmise par diverses espèces de moucherons mordants du genre Culicoides. Les symptômes du bétail atteint de BTV comprenaient une gêne, une forte fièvre et une cyanose de la langue, ce qui donne son nom à la maladie. Chez les moutons, la maladie BTV a une mortalité associée élevée. Jusqu’à la fin des années 1990, l’aire de répartition européenne du BTV était entièrement associée à l’aire de répartition du vecteur C. Imicola. À la fin des années 90 et jusqu’au début des années 2000, il y a eu une expansion sans précédent du BTV dans des régions d’Europe qui font partie de l’aire de répartition d’autres espèces de cécidomyies telles que celles du complexe C. Obsoletus et des espèces de cécidomyies étroitement apparentées. En particulier, une épidémie originaire des Pays-Bas en 2006 est le premier exemple enregistré d’incursion de BTV aux 50 degrés de latitude nord. Au cours des étés suivants, des cas de fièvre catarrhale du mouton ont été découverts dans toute l’Europe du Nord, notamment en Belgique, en Allemagne, au Royaume-Uni et au Danemark, démontrant la capacité de la fièvre catarrhale du mouton à passer l’hiver dans l’environnement du Nord de l’Europe. Une caractéristique déroutante de la sérologie de la fièvre catarrhale du mouton en Europe du Nord est que la maladie a été causée par une souche distincte (BTV-8) de celles responsables des incursions dans le Sud de l’Europe, à savoir l’Espagne (BTV-4) et l’Italie (BTV-2).
La prévision de l’impact de l’incursion de BTV et la meilleure conception de la gestion du bétail et du contrôle des maladies nécessitent une méthodologie de modélisation de pointe. On comprend beaucoup de choses sur l’épidémiologie de la TVB, comme une compréhension solide de la période de virémie attendue pour les hôtes bovins et ovins et de l’effet de la température climatique sur la période d’incubation de la fièvre catarrhale du Mouton au sein de son vecteur de cécidomyie. Cependant, l’estimation du risque spatio-temporel posé par la dispersion des vecteurs loin du bétail hôte infecté reste un défi important. Le problème d’inférence ici est multifactoriel nécessitant non seulement une inférence de paramètres, mais également une sélection de modèles fondée sur des principes statistiques.
Paludisme
Le paludisme suit le cycle de transmission générique tel que décrit précédemment; le vecteur étant la femelle moustique qui prend son repas de sang dans le cadre du processus de reproduction; les mâles de l’espèce sont nectavorieux et en tant que tels ne jouent aucun rôle dans le cycle de transmission. La fréquence d’alimentation est déterminée par ce besoin biologique, de sorte que le taux moyen d’alimentation est généralement d’environ une fois tous les quatre jours et on suppose généralement que la satiété pour un lot d’œufs est obtenue au cours de ce repas. Il existe de nombreux types de paludisme, certains affectant les humains (cela peut être causé par l’un des quatre types de Plasmodium différents) et d’autres affectant les animaux. Le genre Anopheles est responsable de la transmission à l’homme, dont environ seulement 30 espèces sur 400 provoquent principalement la propagation de l’infection.
Une caractéristique clé affectant le paludisme est la température; même si le moustique réside dans la zone donnée, des températures extérieures inférieures à environ 16C (la température exacte dépend de l’espèce de parasite), il n’est pas assez chaud pour permettre le développement. En général, plus la température augmente de 16C plus la période d’incubation est courte avec un arrêt soudain au-dessus d’environ 32C car le parasite n’est pas capable de survivre au-delà de ces températures.
Le paludisme aviaire et le Nid d’abeilles hawaïen
Certains systèmes, cependant, peuvent être beaucoup plus complexes que l’exemple général donné précédemment. Un tel exemple est le Nid d’abeilles hawaïen (Drepanididae); il souffre non seulement des effets néfastes du paludisme aviaire (Plasmodium relictum) qui est transmis par le moustique (Culex quinquefasciatus), mais aussi de ceux du changement climatique et de la prédation. L’interaction entre ces facteurs dominants est grande, les températures et l’abondance des prédateurs affectant l’évolution de la maladie et la capacité (ou l’incapacité) des oiseaux à résister à l’extinction. De plus, certaines espèces du nid d’abeilles présentent la capacité de conférer une résistance au paludisme, ne souffrant d’aucun effet délétère de la maladie tout en restant infectieuses (celles-ci sont plus communément appelées porteuses et provoquent par inadvertance un réservoir d’infection en survivant à l’espérance de vie normale « sans maladie” tout en propageant l’infection.
Ce travail a été publié sous le nom:
K. S. Rock et al. « Modelling the Future of the Hawaiian Honeycreeper: An Ecological and Epidemiological Problem ». Modélisation écologique (juin 2012)