
Le volume molaire (symbole Vm) d’une substance est le volume occupé par une mole de la substance au niveau d’une température et pression données. Elle est égale à la masse moléculaire (M) de la substance divisée par sa masse volumique (ρ) à la température et à la pression données :
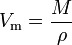
Elle a une unité SI de mètres cubes par mole (m3/mol). Cependant, les volumes molaires sont souvent exprimés en mètres cubes pour 1 000 moles (m3/ kmol) ou en décimètres cubes par mol (dm3/ mol) pour les gaz et en centimètres par mole (cm3/ mol) pour les liquides et les solides.
Si une substance est un mélange contenant N composants, le volume molaire est calculé en utilisant:
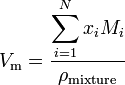
où x i est la fraction molaire du i composant, M i est la masse moléculaire duth composant et pmixture est la densité du mélange à la température et à la pression données.
Lorsque vous indiquez des valeurs numériques de volume molaire, il est important d’indiquer également les conditions données de température et de pression. Sinon, les valeurs numériques n’ont pas de sens.
Gaz idéaux
L’équation de la loi du gaz idéal peut être réarrangée pour donner cette expression pour le volume molaire d’un gaz idéal :
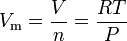
Où en unités SI :
= le volume pression absolue du gaz, en Pa
= nombre de moles, en mol
= le volume molaire du gaz, en m3/mol
= la température absolue du gaz, en K
= la constante de loi universelle du gaz de 8,314472 m3 ·Pa·mol-1 ·K-1
Où en unités usuelles:
= la pression absolue du gaz, en psia
= nombre de moles, en lb-mol
= le volume molaire du gaz, en ft3/lb-mol
= la température absolue du gaz, en degrés Rankine (°R)
= la constante de loi universelle des gaz de 10,7316 ft3 ·psia ·lb-mol-l ·°R-1
Exemple de calculs des volumes molaires des gaz idéaux:
- En unités métriques SI:
Vm = 8,314472 × 273,15 / 101 325 = 0,022414 m3/ mol à 0 °C et pression absolue de 101 325 Pa = 22,414 m3 / kmol à 0 °C (273,15 K) et 101.325 kPa pression absolue Vm = 8,314472 × 273,15 / 100 000 = 0,022711 m3 / kmol à 0 ° C et 100 000 Pa pression absolue = 22,711 m3 / kmol à 0 ° C (273,15 K) et 100 kPa pression absolue
- Dans les unités usuelles:
Vm = 10,7316 × 519,67 / 14,696 = 379,48 pi3 /lb-mol à 60 ° F (519,67 ° R) et 14,696 psia
Notes:
- lb-mol est une abréviation de pound-mol
- °R est degrés Rankine (une échelle de température absolue) et ° F est degrés Fahrenheit (une échelle de température).
- °R = °F +459.67
- La littérature technique peut prêter à confusion car certains auteurs omettent souvent d’expliquer s’ils utilisent la constante de loi universelle des gaz R, qui s’applique à tout gaz idéal, ou s’ils utilisent la constante de loi spécifique des gaz Rs, qui ne s’applique qu’à un gaz individuel spécifique. La relation entre les deux constantes est Rs = R/M où M est la masse moléculaire du gaz.
Les gaz réels
Les gaz réels sont les gaz qui ne présentent pas un comportement de gaz idéal. Pour de tels gaz, la méthode la plus simple de détermination des volumes molaires consiste à utiliser des facteurs de compressibilité comme dans l’expression suivante :
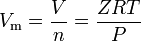
où Z est le facteur de compressibilité des gaz, qui est une propriété thermodynamique utile pour modifier la loi des gaz idéaux pour tenir compte du comportement des gaz réels. L’équation ci-dessus est essentiellement une équation d’état simple (EOS). La limitation majeure de cette équation d’état est que le facteur de compressibilité du gaz, Z, n’est pas une constante mais varie d’un gaz à l’autre ainsi qu’avec la température et la pression du gaz considéré.
Des valeurs plus précises des volumes molaires réels de gaz peuvent être obtenues en utilisant des équations d’état telles que l’équation de van der Waals développée en 1873, l’équation de Redlich-Kwong développée en 1949, l’équation de Soave-Redlich-Kwong développée en 1972 et l’équation de Peng-Robinson développée en 1976.
- 1.0 1.1 Union Internationale de chimie Pure et appliquée (UICPA): Quantités, Unités et Symboles en Chimie physique 2e Édition, 1993
- 2.0 2.1 Guide du NIST sur le SI Point 8.6.3 dans la section 8
- 3.0 3.1 Détermination des valeurs de compressibilité des gaz Informations sur la façon de déterminer les facteurs de compressibilité des gaz et les volumes molaires.
| Certains contenus de cette page sont peut-être déjà apparus sur Citizendium. |